Fe(OH)2很不稳定,露置在空气中容易被氧化,发生反应的方程式为:
为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用FeSO4晶体配制上述FeSO4溶液时我觉得还需加入 来防止Fe2+被氧化。
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)检验Fe3+的最佳试剂是 ,简述其检验方法: 。
根据方程式:Ba(OH)2+(NH4)2SO4 BaSO4↓+2NH3↑+2H2O,请回答:
BaSO4↓+2NH3↑+2H2O,请回答:
⑴(NH4)2SO4属于,H2O属于 ___。(填字母)
A、电解质 B、非电解质 C、胶体
⑵写出(NH4)2SO4的电离方程式: _____ _。
⑶写出该反应的离子方程式: ___。E
向盛有一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度Ⅰ表示)近似的用下图中的曲线表示是( )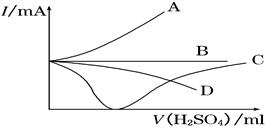
科学家在研究化学物质时,常常对物质进行分类,以便对同类物质的组成和性能进行深入的研究.下列各组物质中有一种物质与其它物质不属于同一类,请将其挑出来,并说明理由。
| 物质组 |
不属于同类的物质 |
理由 |
| (1) Mg、O2 、N2、NO |
||
| (2) NaOH、Na2CO3、CH4、KCl |
||
| (3) H2CO3、H2SO4、NH3·H2O、H2SiO3 |
有以下几种物质①干燥的食盐晶体②液态氯化氢③水银④蔗糖⑤冰醋酸(纯醋酸晶体)⑥KNO3溶液填空回答(填序号):
(1)以上物质能导电的是;
(2)以上物质中属于电解质的是;
(3)以上物质中既不是电解质也不是非电解质的是;
写出下列反应的离子方程式:
(1)烧碱溶液吸收氯气:
(2)钠和硫酸铜溶液反应: