配制250 mL 0.10 mol/L的NaOH溶液时,下列实验操作会使配得的溶液浓度偏小的是 ( )
| A.容量瓶未干燥就直接加水定容 |
| B.在容量瓶中进行定容时仰视刻度线 |
| C.称量的NaOH固体已潮解 |
| D.定容后把容量瓶倒转摇匀,发现液面低于刻度 |
下列变化中,可以看作由加成反应引起的是()
| A.乙炔通入高锰酸钾酸性溶液中,溶液褪色 |
| B.乙烯在一定温度、压强和催化剂的作用下,聚合为聚乙烯 |
| C.在一定条件下,苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成 |
| D.在催化剂的作用下,乙烯与水反应生成乙醇 |
25℃和101kPa时,乙烷,乙炔和丙烯组成的混合径8mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了18mL,原混合烃中乙炔的体积分数为()
| A.12.5% | B.25% | C.50% | D.75% |
每年的6月26日是国际禁毒日,珍爱生命,远离毒品。以下是四种毒品的结构简式,下列有关说法正确的是()
| A.四种毒品中都含有苯环,都属于芳香烃 |
| B.摇头丸经消去、加成反应可制取冰毒 |
| C.1mol大麻与溴水反应最多消耗4mol Br2 |
| D.氯胺酮分子中环上所有碳原子不可能共平面 |
下列物质中,不能使酸性KMnO4溶液褪色的物质是()
①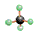 ②乙烯 ③CH3COOH ④CH3CH2OH ⑤CH2="CH-COOH" ⑥
②乙烯 ③CH3COOH ④CH3CH2OH ⑤CH2="CH-COOH" ⑥
| A.①⑥ | B.①③④⑥ | C.①④ | D.①③⑥ |
鉴别CH3OCH3和CH3CH2OH可采用化学方法和物理方法,下列方法不能对二者进行鉴别的是
| A.利用金属钠或金属钾 | B.利用质谱法 |
| C.利用红外光谱 | D.利用核磁共振氢谱 |