短周期元素X、Y的原子序数相差2。下列有关叙述正确的是( )
| A.X与Y不可能位于同一主族 | B.X与Y一定位于同一周期 |
| C.X与Y可能形成共价化合物XY | D.X与Y一定形成离子化合物XY |
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )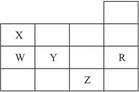
| A.常压下五种元素的单质中Z单质的沸点最高 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.W的氢化物的沸点比X的氢化物的沸点高 |
| D.Y元素的非金属性比W元素的非金属性强 |
在下列元素中,不属于主族元素的是( )
| A.磷 | B.铁 | C.钙 | D.碘 |
2003年,IUPAC(国际纯粹与应用化学联合会)推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国)。下列关于Ds的说法不正确的是()
| A.Ds原子的电子层数为7 | B.Ds是超铀元素 |
| C.Ds原子的质量数为110 | D.Ds为金属元素 |
有三种短周期元素,最外层电子数之和为17,质子数之和为31。如果这三种元素中有一种是氩元素,则关于另外两种元素的说法不正确的是( )
| A.如果一种元素是金属元素,则另一种元素一定是稀有元素 |
| B.如果一种元素的单质通常情况下是气体,则另一种元素的单质通常情况下是固体 |
| C.如果一种元素的气态氢化物是三角锥形分子,则另一种元素的气态氢化物一定是正四面体形分子 |
| D.如果一种元素的最高正价是+3,则另一种元素的单质有两种常见的同素异形体 |