(1)某化学兴趣小组为了探究Cl2的相关性质,设计了如下的实验。
①写出Cl2与水反应的离子方程式 。
②通入Cl2后,从集气瓶A、B的现象可得出的结论是 ;从化学实验的安全环保角度考虑,你认为还应增加的装置是 。
(2)①如图所示,上述实验过程中,不会产生气体的是 ;
②写出反应D的化学方程式 。
(3)碘是人体中不可缺少的微量元素,食盐中加入碘元素能有效防止缺碘引起的疾病。以前在食盐中加入碘化钾(KI),放置一年后,碘流失约92%。现在食盐中加入碘酸钾(KIO3),在相同条件下碘仅损失约7%。
①食盐中加入碘化钾的碘损失率高的原因是 ;
②萃取碘水中的碘时,一般选用的试剂是(填字母) ;
A.酒精 B.四氯化碳 C.醋酸 D.硝酸银溶液
③可用盐酸酸化的碘化钾和淀粉溶液检验食盐中的碘酸钾。反应的化学方程式为:
5KI+KIO3 + 6HCl =" 6KCl" + 3I2 + 3H2O,反应的现象是 。
选做题(本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分)
A.【原创】[物质结构与性质]
氮元素可形成氢化物、氮化物、叠氮化物、卤化物等多种化合物。
(1)肼(N2H4)可用作火箭燃料,1mol N2H4中含有σ键的数目为 。
(2)F2和过量NH3在铜催化作用下反应生成NF3,写出基态铜原子的电子排布式 ;
NF3分子的空间构型为 。
(3)与N3-互为等电子体的一种分子为 (填化学式)。
(4)氰酸(HCN)中碳原子的杂化方式为 。
(5)铁和氨气在640℃发生置换反应生成铁氮化合物,其晶胞结构如图所示,该晶体的化学式为 。
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下放热反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1∆H ="a" kJ/mol (I)
NaNO3(s)+ClNO(g) K1∆H ="a" kJ/mol (I)
2NO(g)+Cl2(g) 2ClNO(g) K2∆H ="b" kJ/mol (II)
2ClNO(g) K2∆H ="b" kJ/mol (II)
(1)反应4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示),∆H= kJ/mol(用a、b表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示),∆H= kJ/mol(用a、b表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后
n(Cl2)= mol。其它条件保持不变,反应(II)在恒压条件下进行,平衡常数
K2 (填“增大”“减小”或“不变”)。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2-)和c(CH3COO‾)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol•L‾1,CH3COOH的电离常数K a=1.7×10-5mol•L‾1)
(4)由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
选做题(本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分)
A.【改编】[物质结构与性质]
过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。
(1)Fe基态核外电子排布式为 。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的第一电离能由大到小的顺序为 。
(3)与OCN-互为等电子体的一种分子为 (填化学式)
(4)铁元素还能与一些氨基酸形成配合物,羧基中碳原子的杂化类型是 ;1mol乙酸中含有σ键的数目为 。
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。
该合金的化学式为 。
(14分)氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)某课外学习小组欲制备少量NO气体,写出铁粉与足量稀硝酸反应制备NO的离子方程式: 。
(2)LiFePO4是一种新型动力锂电池的电极材料。
①下图为某LiFePO4电池充、放电时正极局部放大示意图,写出该电池放电时正极反应方程式: 。
②将LiOH、FePO4·2H2O(米白色固体)与还原剂葡萄糖按一定计量数混合,在N2中高温焙烧可制得锂电池正极材料LiFePO4。焙烧过程中N2的作用是 ;实验室中以Fe3+为原料制得的FePO4·2H2O有时显红褐色,FePO4·2H2O中混有的杂质可能为 。
(3)磷及部分重要化合物的相互转化如图所示。
①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是 。
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为 。
③步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有 。
[化学——物质结构与性质]
氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的两个关键环节。
Ⅰ.氢气的制取
(1)水是制取氢气的常见原料,下列说法正确的是 (填序号)。
A.H3O+的空间构型为三角锥形
B.水的沸点比硫化氢高
C.冰晶体中,1 mol水分子可形成4 mol氢键
(2)科研人员研究出以钛酸锶为电极的光化学电池,用紫外线照射钛酸锶电极,使水分解产生氢气。已知钛酸锶晶胞结构如图,则其化学式为 。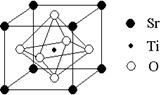
Ⅱ.氢气的存储
(3)Ti(BH4)2是一种储氢材料。
①Ti原子在基态时的核外电子排布式是 。
②Ti(BH4)2可由TiCl4和LiBH4反应制得,TiCl4熔点-25.0℃,沸点136.94℃,常温下是无色液体,则TiCl4晶体类型为 。
(4)最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子。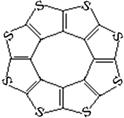
①元素电负性大小关系是:C S(填“>”、“=”或“<”)。
②分子中C原子的杂化轨道类型为 。
③有关键长数据如下:
| C—S |
C=S |
C16S8中碳硫键 |
|
| 键长/pm |
181 |
155 |
176 |
从表中数据可以看出,C16S8中碳硫键键长介于C—S与C=S之间,原因可能是: 。
④C16S8与H2微粒间的作用力是 。