某学习小组拟通过实验探究绿矾(FeSO4·7H2O)热分解的产物。
【实验前准备】
(1)理论分析 小组成员从理论上分析,认为下列分解产物不可能的是 。
a.Fe2O3、SO3、H2O b.Fe2O3、SO2、SO3、H2O
c.FeO、Fe2O3、SO2、SO3、H2O
(2)查阅资料 常压下SO3熔点16.8℃,沸点44.6℃
【实验探究】
针对以上可能的组合猜想,该学习小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):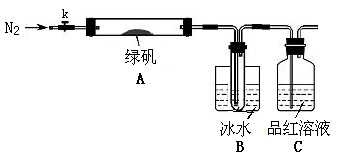
(3)实验过程
①仪器连接后,检查装置A与B气密性的操作为 。
②取一定量绿矾固体置于A中,通入N2以驱尽装置内的空气,关闭k,用酒精灯加热
双通管。
③观察到A 中固体逐渐变红棕色,B中试管收集到无色液体,C中溶液褪色。
④待A中反应完全并冷却至室温后,取少量反应后固体于试管中,加入硫酸溶解,取
少量滴入几滴KSCN溶液,溶液变红色。
⑤往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊。
( 4)实验结果分析
结论1:B中收集到的液体是 。
结论2:C中溶液褪色,可推知产物中有 。
结论3:综合分析上述实验③和④可推知固体产物一定有Fe2O3。
【实验反思】
(5)请指出该小组设计的实验装置的明显不足: 。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,
选用一种试剂鉴别,该试剂最合适的是 。
a.氯水和KSCN溶液 b.酸性KMnO4溶液 c. H2O2 d. NaOH溶液
CuCl是应用广泛的有机合成催化剂,可采取不同方法制取。
方法一铜粉还原CuSO4溶液
已知:CuCl难溶于水和乙醇,在水溶液中存在平衡:CuCl(白色)+ 2Cl- [CuCl3]2-(无色溶液)。
[CuCl3]2-(无色溶液)。
(1)将废铜板浸入热的H2SO4溶液中,并通入空气,可以生成CuSO4。该反应的离子方程式为。
(2)①中,“加热”的目的是,当观察到现象,即表明反应已经完全。
(3)②中,加入大量水的作用是。
(4)潮湿的CuCl在空气中易发生水解和氧化。上述流程中,为防止水解和氧化所添加的试剂或采取的操作是。
方法二铜电极电解饱和食盐水(实验装置如图)
(5)阳极的电极反应式为。
(6)实验开始时,阳极附近没有产生CuOH沉淀的原因是。
(已知:Ksp(CuCl)=1.2×10-6,Ksp(CuOH)=1.2×10-14)
(1 5分)无水氯化铝是有机化工常用的催化剂,氯化铝178℃时升华,极易潮解,遇水发热并产生白色烟雾。氯化铝还易溶于乙醇、氯仿和四氯化碳。
实验室可用反应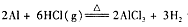 制备少量无水氯化铝,某同学利用该原理设计如下实验装置:
制备少量无水氯化铝,某同学利用该原理设计如下实验装置: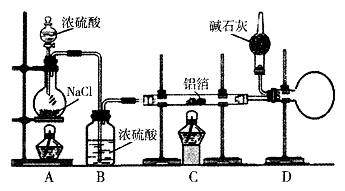
(1)A烧瓶中发生反应的化学方程式:
(2)以下三步操作的先后顺序为(填序号)。
①点燃A处酒精灯
②点燃C处酒精灯
③滴加A处浓硫酸
(3)D中干燥管内碱石灰的作用是。
(4)下列有关AICl3的说法合理的是(填序号)。
①AlCl3水溶液能导电
②熔融态AlCl3能导电
③镁条能置换出AlCl3溶液中的Al
(5)实验室也可通过反应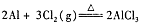 制备无水氯化铝,此法若还利用上述装置,在A烧瓶中增用Mn02。固体之外,还必须对装置进行的改动是。
制备无水氯化铝,此法若还利用上述装置,在A烧瓶中增用Mn02。固体之外,还必须对装置进行的改动是。
(6)指出该实验装置可能存在的一种安全隐患:。
电子工业中,可用FeCl3—HCl溶液作为印刷电路铜板蚀刻液。某探究小组设计如下线路处理废液和资源回收:
请回答:
(1)FeCl3—HCl溶液蚀刻铜板后的废液中含有的金属阳离子是。
(2)FeCl3蚀刻液中加入盐酸的目的:可以,又可提高蚀刻速率。
(3)步骤①中加入H2O2溶液的目的是。
(4)已知:生成氢氧化物沉淀的pH
| Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
| 开始沉淀时 |
4.7 |
7.0 |
1.9 |
| 沉淀完全时 |
6.7 |
9.0 |
3.2 |
根据表中数据推测调节pH的范围是。
(5)写出步骤②中生成CO2的一个离子方程式_____(已知Cu2(OH)2CO3不易溶于水)。
(6)写出步骤③生成Cu2(OH)2CO3的离子方程式___________________。
某化学探究小组拟用废铜屑制取Cu(NO3)2:,并探究其化学性质。
I.如图,用浓HNO3,和过量的废铜屑充分反应制硝酸铜溶液。
(1)写出铜与浓硝酸反应的离子方程式。
(2)①装置中NaOH溶液的作用是。
②欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤是蒸发浓缩、、过滤。
③你认为此装置是否合理,并说明原因。
如果不合理,同时在原装置上改进;如果合理,只需说明原因。
Ⅱ.为了探究 的热稳定性,探究小组按下图装置进行实验。(图中铁架台、铁夹和加热仪器均略去)
的热稳定性,探究小组按下图装置进行实验。(图中铁架台、铁夹和加热仪器均略去)
【实验装置】
【实验操作及现象】往试管中放人研细的无水Cu(NO3)2:晶体并加热,观察到试管中有红棕色气体生成,最终残留黑色粉末;用U型管除去红棕色气体,在集气瓶中收集到无色气体。
【解释与结论】
(3)①红棕色气体是。
②根据现象判断 在加热条件下可以分解,其化学反应方程式为。
在加热条件下可以分解,其化学反应方程式为。
Ⅲ.利用Cu(NO3)2制备浅绿色的碱式碳酸铜[CuCO3·Cu(OH)2]。
向大试管中加入一定量的碳酸钠溶液和硝酸铜溶液,水浴加热,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡、静置、过滤、洗涤、干燥,得到样品。
【实验数据】反应温度对样品的影响
| 实验序号 |
1 |
2 |
3 |
4 |
| 温度/℃ |
35 |
50 |
70 |
95 |
| 样品颜色 |
深蓝色 |
深蓝色 |
浅绿色 |
暗蓝色 |
| 样品中碱式碳酸铜 的质量分数/% |
90.9 |
92.7 |
x |
92.0 |
(4)滤液中可能含有 ,写出检验
,写出检验 的方法。
的方法。
(5)95℃时,样品颜色发暗的原因:____。
(6)70C时,实验得到2.38 g样品,取此样品加热至分解完全(杂质不分解),得到1.76 g固体,此样品中碱式碳酸铜的质量分数是。
50 mL 0.5 mol·L—1盐酸与50 mL 0.55 mol·L—1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热(中和热是指酸和碱中和生成1 mol H2O所放出的热量)。
(1)从实验装置上看,图中尚缺少的一种用品是_________________________。
(2)烧杯间填满碎纸条的作用是____________________________________。
(3)若大烧杯上不盖硬纸板,求得中和热数值将_________(填“偏大”、“偏小”或“无影响”)。
(4)实验中改用60 mL 0.50 mol·L—1盐酸跟50 mL 0.55 mol·L—1,NaOH溶液进行反应。
与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热的数值_________(填“相等”或“不相等”),理由是___________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会_________(填“偏小”、“偏大”或“无影响”)。