对于实验I~IV的实验现象预测正确的是 
| A.实验I :逐滴滴加盐酸时,试管中立即产生大量气泡 |
| B.实验II:充分振荡后静置 |
| C.实验III:从饱和食盐水中提取NaCl晶体 |
| D.装置IV:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去 |
一溴代烃A在碱性条件下水解的产物经酸性高锰酸钾氧化得到有机物B ,A 的一种同分异构体经水解得到有机物C ,B 和C 可发生酯化反应生成酯D ,则D 可能是
| A.(CH3)2CHCOOC(CH3)3 |
| B.(CH3)2CHCOOCH2CH(CH3)2 |
| C.CH3(CH2)2COOCH2(CH2)2CH3 |
| D.(CH3)2CHCOOCH2CH2CH3 |
已知苯环上由于取代基的影响,使硝基邻位上的卤原子可被羟基取代 ,现有某有机物的结构简式如图。1mol该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为
,现有某有机物的结构简式如图。1mol该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为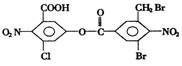
A.5mol B6mol C.7mol D.8mol
下列五种物质:①甲醇②甲醛③甲酸④甲酸甲酯⑤苯甲酸甲酯 ,其中能发生银镜反应的有
A.一种 B.二种 C.三种 D四种
10个碳原子以下的烷烃其一氯代物只有一种结构的有
| A.2种 | B.4种 | C.6种 | D.8种 |
两种有机物以一定比例混合,一定条件下在aLO2(足量)中燃烧,充分反应后恢复到原状,再通过足量Na2O2层,得到气体仍是aL,下列混合有机物中符合此条件的是
| A.CH4、C2H4 | B.HCHO、CH3COOCH3 | C.C2H6、HCHO | D.CH3OH、CH3COOH |