A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,余均为常见化合物,J是一种黑色固体,I的浓溶液具有还原性,A—J的所有物质之间有如下的转化关系(部分反应产物省略): 
(1)B元素和C元素的简单离子半径大小关系是 (用离子符号表示):
(2)将氮元素与C形成的化合物NC3加入水中产生使红色石蕊试纸变蓝的气体,写出该反应的化学方程式 ;
(3)由E的饱和溶液滴入沸水中形成透明液体,再将此液体装入U型管,并在U型管的两端插入电极,接通直流电,在阳极端可观察到的现象是 ;
(4)将适量J加入酸化的H2O2的溶液中,J溶解生成它的+2价离子,该反应的离子方程式是
;
(5)向含有0.1 mol G的溶液中滴加5 mol/L 的盐酸溶液,得到沉淀3.9 g ,则加入盐酸的体积可能为 。
有A、B、C、D、E五种元素,A元素形成的-2价阴离子比氦的核外电子数多8个。B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质。C为原子核内有12个中子的二价金属,当2.4 g C与足量盐酸反应时,生成标准状况下的H2 2.24 L。D的原子M层上有7个电子,E与A同周期且最外层比次外层多3个电子。
(1)C离子的结构示意图。
(2)A、E氢化物的稳定性比较。(填化学式)
(3)A、B、C、D四种离子半径由大到小顺序(用离子符号表示)
(4)写出Cu与E的最高价氧化物对应水化物稀溶液反应的离子反应方程式:
。
(5)写出实验室制E的氢化物的化学反应方程式。
下表列出了A—R九种元素在周期表中的位置,用元素符号或化学式填空。
 主族 主族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
E |
F |
||||||
| 3 |
A |
C |
D |
G |
R |
|||
| 4 |
B |
H |
(1)这九种元素中:化学性质最不活泼的是;金属性最强的是 ;最高价氧化物的水化物碱性最强的碱是;最高价氧化物的水化物酸性最强的酸是。
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式是
。
(3)A、B、C三种元素按原子半径由大到小的顺序排列的为。
(4)F的氢化物的电子式;G、H 氢化物的稳定性递减的顺序是。
(5)H元素跟A元素形成的化合物的化学式是;该化合物做焰色反应时火焰呈色。
(6) B和G两种元素形成的化合物属于(填“离子化合物”或“共价化合物”),请用电子式表示其形成过程。
相对分子质量不超过200的某芳香族化合物,欲确定其结构,学习小组的同学进行了一系列实验,获得如下信息:
I.元素分析证明:该物质只含C、H、O三种元素,且氧元素的质量分数为31.6%。
II.该物质不能与FeCl3溶液发生显色反应,其苯环上的一元取代物有两种。
III.0.1mol该有机物分别与足量NaHCO3溶液或足量金属钠反应,均可放出2.24L气体(体积均已折算为标准状况下的体积)。
(1)该有机物的结构简式是。
(2)写出同时符合以下条件的该有机物的两种同分异构体的结构简式:。
。
(①苯的对位二元取代物②能够发生银镜反应③遇FeCl3溶液发生显色反应)
(3)第(2)小题中有一种物质还能发生水解反应,写出该物质发生下列反应的方程式
①与Na2CO3溶液反应:
②与NaOH溶液反应:
有机物G是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成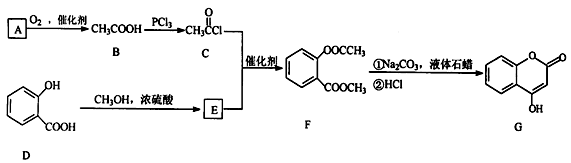
请回答下列问题:
(1)A与银氨溶液反应有银镜生成,则A的结构简式是。
(2)B→C的反应类型是。
(3)E的结构简式是。
(4)写出F和过量NaOH溶液共热时反应的化学方程式:。
(5)下列关于G的说法正确的是
a.能与溴单质反应 b.能与金属钠反应
c.1molG最多能和3mol氢气反应 d.分子式是C9H7O3
(6)与D互为同分异构体且含有酚羟基、酯基的有种
某有机物A分子式为CxHyOz,15gA完全燃烧生成22gCO2和9gH2O。
(1)求该有机物的最简式
(2)若A是一种无色具有强烈刺激气味的气体,具有还原性,则其结构简式是_____________。
(3)若A和Na2CO3混合有气体放出,和醇发生酯化反应,则A的结构简式为:_________。
(4)若A是易挥发有水果香味的液体,能发生水解的反应,则其结构简式为:___________。