化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”提纯金属钨的反应原理为W(s)+I2(g) WI2(g) (I)。该反应在石英真空管中进行,如下图所示:
WI2(g) (I)。该反应在石英真空管中进行,如下图所示:
①反应(I)的平衡常数表达式K=_______,若K=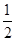 ,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
②反应(I)的△H____0(填“>”或“<”),上述反应体系中可循环使用的物质是_________。
③能够说明上述反应已经达到平衡状态的有_________(填序号)。
a.I2与WI2的浓度相等
b.W的质量不再变化
c.容器内混合气体的密度保持不变
d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等
(2)25℃时,NaHSO3的水解平衡常数=1.0×10-12mol/L,则该温度下H2SO3 HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中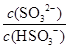 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
(3)直接排放含SO2的烟气会形成酸雨,危害环境。用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-): n ( HSO3-) |
91:9 |
1:1 |
1:91 |
| pH(25℃) |
8.2 |
7.2 |
6.2 |
当吸收液呈中性时,溶液中离子浓度由大到小的顺序为_________________________。
(1)如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中央滴入浓硫酸铜溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)当杠杆为绝缘体时,A端比B端(填高、低、不变。下同);当杠杆为导体时,A端比B端。
(2)依据氧化还原反应:Fe+Cu2+=Fe2++Cu设计的原电池如下图所示,其中Y为可溶性硫酸盐。

请回答下列问题:
①电解质溶液Y是;(填化学式)
②X电极发生的电极反应为;
③装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是________。
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(3)把(2)中盐桥改为铁棒插入A、B池中,其它不变,电流计的指针 (填“会”、“不会”)发生偏转,A装置名称 填(“原电池”或“电解池”),A中溶液浓度 (填增大、不变、变小),铜棒的电极名称为 (填“正极”、“负极”、“阴极”或“阳极”)
(4)把(2)中盐桥改为铜棒,其它不变,电流计的指针 (填“会”、“不会”)发生偏转,理由是 。
在某一容积为5 L的密闭容器内,加入 0.3 mol的CO和0.3 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g)ΔH>0,反应中CO2的浓度随时间变化情况如图:
CO2(g)+H2(g)ΔH>0,反应中CO2的浓度随时间变化情况如图:
(1)根据图上数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)=mol/(L·min)-1,该温度下的平衡常数K=。
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有(填字母)
A升高温度;B降低温度;C增大压强;D减小压强;E加入催化剂;G移出一氧化碳气体
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.2 mol的CO2和0.2 mol的H2,在相同的条件下,反应达平衡时,c(CO)=mol/L。
(4)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,CO的转化率(填“升高”、“降低”还是“不变”),CO2的质量分数(填“升高”、“降低”还是“不变”)。
(5)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L,c(CO2)=c(H2)=0.13mol/L,则此反应是否处于平衡状态(填“是”或“否”),若没有处于平衡状态则该反应向移动。(填“正方向”或“逆方向”)
按要求写出下列方程
(1)碳酸钠溶液呈碱性的原因,用离子方程表示。
(2)用锌保护海底钢铁设施,其中负极发生的电极反应为:。
(3)含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则表示该反应中和热的热化学方程式。
(4)氢氧化镁溶解在浓的氯化铵溶液,用离子方程表示。
(5) Al(OH)3的电离反应方程式:。
下图为某实验小组制取乙酸乙酯的实验装置图,烧瓶中盛有乙醇和浓H2SO4。反应时,将乙酸从分液漏斗滴入烧瓶中即可。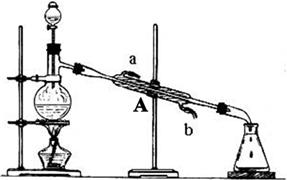
①为方便研究酯化反应的过程,乙醇中的氧原子用18O进行了标记(即C2H518OH),请用氧的同位素示踪法写出乙酸与乙醇发生酯化反应的化学方程式:。
②装置A的名称是,使用时要先从口(填“a”或“b”)进水。
③实验结束后,锥形瓶中收集到乙酸乙酯、乙醇和乙酸的混合液。为了将这三者进行分离,该小组依如下流程进行了进一步的实验: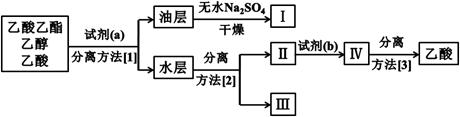
试剂(a)是,试剂(b)是,
分离方法(1)是,分离方法(2)是,分离方法(3)是。
食品添加剂必须严格按照食品安全国家标准(GB2760-2011)的规定使用。常作为食品添加剂中的防腐剂W,可以经过如下反应路线合成(部分反应条件略)。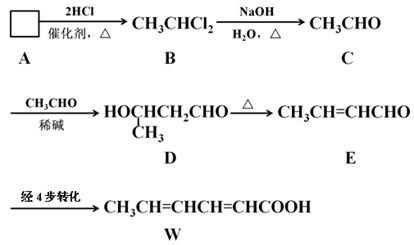
①已知A→B为加成反应,则A的结构简式为。请用化学方程式表示实验室制取A的原理:。
②用D的同分异构体D1制备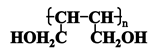 。
。
a、D1的结构简式为;
b、为避免副反应R-OH+R-OH R-O-R+H2O的发生,合理的制备途径可以按照酯化、、的顺序依次进行(填反应类型)。
R-O-R+H2O的发生,合理的制备途径可以按照酯化、、的顺序依次进行(填反应类型)。
③已知乙烯不能被弱氧化剂氧化。依C→D→E的原理,由E制备W的4步转化为:
第1步:(用化学方程式表示);
第2步:消去反应;
第3步:(用化学方程式表示);
第4步:加适量稀酸酸化,提纯。