工业上利用铬铁矿(FeO Cr2O3)冶炼铬的工艺流程如下:
Cr2O3)冶炼铬的工艺流程如下: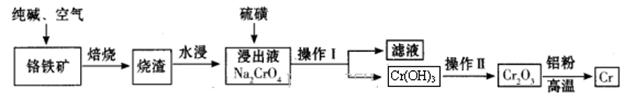
(1)实验室焙烧铬铁矿可选用的装置是__________(填序号)。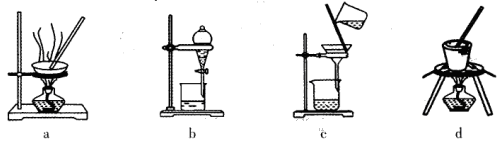
(2)完成下列化学方程式(在横线上填写物质的化学式及计量数):4CrO42-+6S+7H2O=4Cr(OH)3↓+3S2O32-+_____________。
(3)操作I包括过滤与洗涤,简述实验室中洗涤沉淀的操作:__________________。
(4)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出Cr(OH)3溶于浓氢氧化钠溶液的离子方程式________________________________。
(5)由Cr2O3冶炼Cr的化学方程式为____________________________。
(6)目前有一种采用以铬酸钠(Na2CrO4)为原料,用电化学法制备重铬酸钠(Na2Cr2O7)的实验装置如下图所示(已知:2CrO42-+2H+ Cr2O72-+H2O)。
Cr2O72-+H2O)。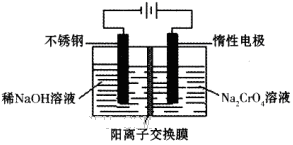
①写出阴极的电极反应式为________________________________________。
②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则此时铬酸钠的转化率为___。
用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
(1)实验过程如下图所示,分析判断________段化学反应速率最快,_______段收集的氢气最多。
这段反应速率最快的原因是。
(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是
| A.蒸馏水 | B.氯化钠固体 | C.氯化钠溶液 | D.浓盐酸 |
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?(至少回答一种)
。
已知X、Y、Z、W四种元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Y、Z、W四种元素的符 号:X、Y、Z、W
号:X、Y、Z、W
(2)X与Y所形成的化合物的化学式为______________,是化合物。用电子式表示其形成过程________________________ ________________。
________________。
下表列出了A~M 13种元素在周期表中的位置:
| 1 |
A |
|||||||
| 2 |
B |
C |
D |
E |
||||
| 3 |
F |
G |
H |
I |
J |
K |
||
| 4 |
L |
M |
(1)这些元素中,金属性最强的元素是_______(填元素名称,下 同),非金属性最强的是__________,最不活泼的元素
同),非金属性最强的是__________,最不活泼的元素 是_________。
是_________。
(2)写出H元素的最高价氧化物对应的水合物分别与F元素的最高价氧化物对应的水合物、J元素氢化物的水溶液反应的离子方程式_________________、。
(3)I2—、J-、L+、M2+等微粒中,半径最大的是________,最小的是__________。
(4)A与D形成的化合物A2D2是___________化合物,其电子式为_____________________。
在室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可按下面框图进行反应。又知E溶液是无色的,请回 答:
答: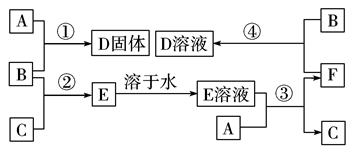
(1)写出下列物质的化学式:
A____________,B____________,C____________。
(2)反应①的化学方程式为: 。
(3)反应③的化学方程式为: 。
(4)反应④的离子方程式为: 。
已知X、Y、Z、W是短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子 数的2倍。
数的2倍。 试回答:
试回答:
(1) 写出下列元素的元素符号:X_________、Y_________、Z_________、 W_________。
W_________。
(2 这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量NaOH溶液反应的离子方程式为。
(3) 将9g单质Y在足量W单质中燃烧,所得气体通入1L 1mol·L-1 NaOH溶液中,完全吸收后,将溶液在减压低温条件下蒸干,得到不含结晶水的固体质量为g。