由某金属的混合物(含65%Cu、25%Al、8%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线设计如下:
已知物质开始沉淀和沉淀完全时pH如下表:
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Cu(OH)2 |
| 沉淀开始时pH |
2.7 |
4.1 |
8.3 |
| 沉淀完全时pH |
3.7 |
5.4 |
9.8 |
请回答下列问题:
(1)过滤操作用到的玻璃仪器有________。
(2)第①步Al与足量酸反应的离子方程式为___________________________,
得到滤渣1的主要成分为________。
(3)第②步用NaOH调节溶液pH的范围为________。
(4)由第③步得到CuSO4·5H2O晶体的步骤是将滤液2________、________、过滤、洗涤、干燥。
(5)现有洗涤后的滤渣2制取Al2(SO4)3·18H2O,请将a、b、c补充完整。
(14分)下图表示有关的一种反应物或生成物(无关物质已略去),其中A、C为无色气体,请填写下列空白。
(1)化合物W可能是____________或__________,C是____________,F是____________。
(2)反应①中若消耗Na2O2 7.8 g,则转移的电子数为______________________。
(3)反应③的离子方程式:__________________________________________。
(4)A与CuO在加热条件下能反应生成N2和Cu,请写出该反应的化学方程式:
_____________________________________________________________________。
完成下列化学方程式或离子方程式。
①.过氧化钠与二氧化碳反应化学方程式:
②.铝和NaOH溶液反应化学方程式:
③.氢氧化铝和NaOH溶液反应离子方程式:
④.硫酸亚铁与氢氧化钠溶液离子方程式:
⑤.FeCl3和Cu反应离子方程式:
(1)选择填空:将铝的用途与性质搭配起来(每个选项只选用一次)。
| A.质轻 |
| B.延展性好 |
| C.易传热 |
| D.易导电 |
E.氧化时放热
①太阳能热水器:__________;②飞机:__________;③焊接铁轨:____________;④电缆:__________;⑤铝箔:__________。
(2)佛山是有色金属之乡,其中铝合金材料的产量约占全国的一半。铝合金材料属于__________(填“纯净物”、“混合物”或“单质”)。
(选做题16分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为:CrO42- Cr2O72-
Cr2O72-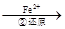 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显色。
(2)能说明第①步反应达平衡状态的是。
A.Cr2O72-和CrO42-的浓度相同
B.2v (Cr2O72-)=" v" (CrO42-)
C.溶液的颜色不变
(3)第②步中,还原1molCr2O72-离子,需要mol的FeSO4 7H2O。
7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在沉淀溶解平衡,请写出其沉淀溶解平衡方程式
常温下,Cr(OH)3的溶度积Ksp=[Cr3+]·[OH−]3=10−32,要使c(Cr3+)降至10−5mol/L,溶液的pH应调至。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因是。
⑹在阴极附近溶液pH升高的原因是(用电极反应解释),溶液中同时生成的沉淀还有。
(选做题12分)
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeC03的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeC03固体。
ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用。
(3)Ⅲ中,生成FeCO3的离子方程式是。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式。
(4)IV中,通过检验SO42-来判断沉淀是否洗涤干净。检验SO42的操作是。
(5)已知煅烧FeC03的化学方程式是4FeCO3+O2 2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是Kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是Kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)