已知NO2和N2O4可以相互转化:2NO2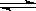 N2O4(正反应为放热反应)。现将一定量NO2和N2O4的混合气体通入体积为1L的恒容密闭容器中,反应体系中物质浓度随时间变化关系如图所示,回答问题:
N2O4(正反应为放热反应)。现将一定量NO2和N2O4的混合气体通入体积为1L的恒容密闭容器中,反应体系中物质浓度随时间变化关系如图所示,回答问题: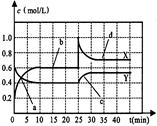
(1)图中共有两条曲线X和Y,其中曲线 表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
(2)前10min内用NO2表示的化学反应速率v(NO2) = mol/(L·min);反应进行至25min时,曲线发生变化的原因是 。
(3)若要达到与最后相同的化学平衡状态,在25min 时还可以采取的措施是
| A.加入催化剂 | B.缩小容器体积 |
| C.升高温度 | D.加入一定量的N2O4 |
(6分)糖类是绿色植物光合作用的产物,都是由(填元素符号)组成的。其中,葡萄糖能发生银镜反应说明具有(填“氧化”或“还原”)性。淀粉是天然高分子糖类,在人体内发
生反应(填加成、水解等反应类型),产物为二糖。
下列是元素周期表的中的部分元素,请回答。
| 周期 族 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
① |
② |
③ |
④ |
||||
| 三 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
(1)表中所标出的元素当中,最活泼的金属元素是;常用作半导体材料的硅元素是,它的最高价氧化物的化学式是。
(2)向污水中加入含有元素⑦的(填名称,下同)做混凝剂,可以使水中的悬浮颗粒物沉降;元素⑨的单质与水反应的产物具有强氧化性,可杀死水中的细菌。
化学无处不在,了解一些与食品相关的化学知识很有意义。
(1)薯片等容易挤碎的食品,宜选用充气袋装。袋装食品可充入的气体是________。
A.氮气 B.二氧化碳C.氧气
(2)为使面包松软可口,通常用碳酸氢钠作发泡剂。因为它________。
①提供钠离子 ②增加甜味 ③与酸产生二氧化碳
A.②③B.①③ C.①②
(3)苯甲酸钠(C6H5COONa)是常用的食品防腐剂。下列描述错误的是________。
A.苯甲酸钠属于盐类
B.苯甲酸钠能溶于水
C.苯甲酸钠属于烃类
合理选择饮食是保证身心健康的重要方面。请回答。
(1)高温消毒灭菌时,蛋白质发生________,失去生理活性。
(2)粮食中的糖类在人体内转化为_____________而被吸收,为人体提供营养。
(3)既能为人体提供热量, 又能提供必需脂肪酸的物质是____________。
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液c;M、N是两块电极板,通过导线与直流电源相连。
请回答以下问题:
(1)若M、N都是惰性电极,c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试液,则:极(填“M”或“N”)附近先呈红色;电解饱和NaCl溶液的总反应方程式:。
(2)若要进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,电解液c选用CuSO4溶液,则:
①N电极反应式是。(说明:杂质发生的电极反应不必写出)
②下列说法正确的是________。
| A.电能全部转化为化学能 |
| B.在电解精炼中,电解液中有Al3+、Zn2+产生 |
| C.溶液中Cu2+向阳极移动 |
| D.阳极泥中可回收Ag、Pt、Au等金属 |
(3)用惰性电极电解CuSO4溶液。若阴极析出Cu的质量为16g,则阳极上产生的气体在标准状况下的体积为 L 。