原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为________,第一电离能最小的元素是________(填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是________(填化学式),呈现如此递变规律的原因是___________________。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为________。另一种的晶胞如图二所示,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为________________________________________________g·cm-3(保留两位有效数字)。(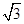 =1.732)
=1.732)
图一 图二 图三
(4)D元素形成的单质,其晶体的堆积模型为________,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是________(填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是________。请写出上述过程的离子方程式:_________________________________________。
纯碱、烧碱等是重要的化工原料。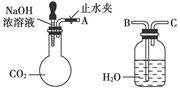
(1)利用上图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是,若其他操作不变,将A与C连接,可观察到的现象是。
(2)向NaOH溶液中通入一定量CO2,结晶后得到白色固体,该白色固体的组成可能是
| A.NaOH和Na2CO3; | |
| B.; | |
| C.; | D.。 |
(3)设计实验确定(2)中白色固体中存在A项中的阴离子:
| 实验操作 |
实验现象 |
结论 |
| (1)取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 |
||
| (2) |
用大试管收集一试管NO2气体,倒扣在盛水的水槽里,试管内产生的现象为;再往试管里通入适量氧气,试管内又产生的现象为。产生上述现象的原因是
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是__________ ______________________________________。
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。写出生成Fe2+所有可能的离子反应方程式:。
若要确认其中有Fe2+,应选用(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应的化学方程式为:。
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为。
已知有以下物质相互转化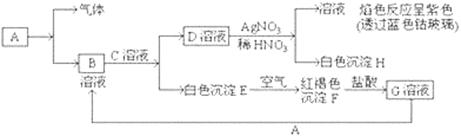
试回答:(1)写出E的化学式,H的化学式。
(2)写出由E转变成F的化学方程式。
(3)检验G溶液中的金属阳离子的方法是:;
向G溶液加入A的有关离子反应方程式。
(4)写出A在一定条件下与水反应的化学方程式。
如下图所示中各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C和D为无色气体,C能使湿润的红色石蕊试纸变蓝,X分解产生A、B和C三种产物的比值为1:1:1。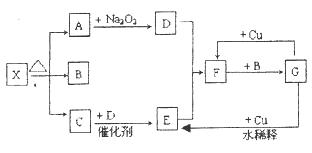
(1)写出下列各物质的化学式:
X:;B:;F:;G:。
(2)按要求写出下列变化的反应化学方程式:
A→D的化学反应方程式:;
G→E的离子反应方程式:。