姜黄素具有抗突变和预防肿瘤的作用,其合成路线如下: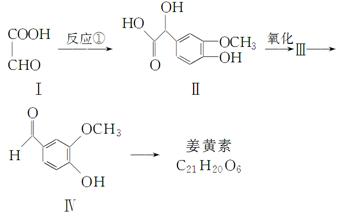
化合物Ⅰ可以由以下合成路线获得:
(1)有机物Ⅳ的分子式为________,含有官能团的名称为醚键和________。
(2)有机物Ⅴ的名称为________,其生成Ⅵ的化学方程式为(注明反应条件):_________________________________________________________________。
(3)写出一种符合下列条件的Ⅳ的同分异构体的结构简式
_______________________________________________________。
①苯环上的一硝基取代物有2种
②1 mol该物质水解,最多消耗3 mol NaOH
(4)反应①中反应物的原子利用率为100 %,请写出该反应的化学方程式
____________________________________________________________。
已知氧化还原反应:NaNO2+NH4Cl——NaCl+H2O+N2↑,若得到m mol的N2,则电子转移数为__________个,此时氧化产物与还原产物的质量之比为____________。
对于CO中毒、心肌梗塞、冠心病或小儿肺炎等危重患者都要采用吸氧治疗。普通医务室中没有氧气瓶,但一般都有消毒用的30%的过氧化氢溶液。同时还有可选用的试剂:KMnO4、HCl、H2SO4、MnO2、Mg粉、CuSO4、NaCl、葡萄糖。请写出一种能使过氧化氢中氧完全释放出来的反应方程式:_____________________________________________。
有两份铜屑,将它们分别与足量的浓H2SO4和稀HNO3完全反应。若放出的气体在常温常压下体积相同,则这两份铜屑的质量比是________。
配平下列氧化还原方程式,并完成以下问题。
(1)P4+HNO3+H2O——H3PO4+NO↑,该反应中氧化产物是_____________________。
(2)Fe+H2SO4(浓)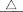 Fe2(SO4)3+SO2↑+H2O,此反应中,被氧化的元素名称是________,所得还原产物名称为________。
Fe2(SO4)3+SO2↑+H2O,此反应中,被氧化的元素名称是________,所得还原产物名称为________。
在2KMnO4+16HCl(浓)====2KCl+2MnCl2+5Cl2↑+8H2O的反应中,________是氧化剂,________是还原剂,________元素被氧化,________元素被还原,氧化产物是________,还原产物是________。此反应中,HCl表现的性质有________性和________性。