T K时,向2.0 L恒容密闭容器中充入1.0 mol COCl2,反应COCl2(g) Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s |
0 |
2 |
4 |
6 |
8 |
| n(Cl2)/mol |
0 |
0.16 |
0.19 |
0.20 |
0.20 |
下列说法正确的是( )。
A.反应在前2 s 的平均速率v(CO)=0.080 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时,c(Cl2)=0.11 mol·L-1,则反应的ΔH<0
C.T K时起始向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,反应达到平衡前v正>v逆
D.T K时起始向容器中充入1.0 mol Cl2和0.9 mol CO,达到平衡时,Cl2的转化率小于80%
对下列化学用语的理解和描述均正确的是
A.电子式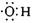 可以表示羟基.也可以表示氢氧根离子 可以表示羟基.也可以表示氢氧根离子 |
B.填充模型 可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 |
C.原子结构示意图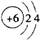 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |
D.结构示意图为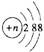 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 |
化学与人类生产、生活、社会可持续发展密切相关,下列说法不正确的是
| A.“天宫一号”中使用的碳纤维,是一种新型无机非金属材料 |
| B.为防止富脂食品氧化变质,常在包装袋中放入生石灰 |
| C.开发新能源,减少对化石燃料的依赖,可以促进低碳经济 |
| D.“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 |
元素周期表中ⅣA元素包括C、Si、Ge、Sn、Pb等,已知Sn的+4价稳定,而Pb的+2价稳定。结合所学知识,判断下列反应中(反应条件略)正确的是
①Pb+2Cl2=PbCl4②Sn+2Cl2=SnCl4③SnCl2+Cl2=SnCl4
④PbO2+4HCl=PbCl4+2H2O ⑤Pb3O4+8HCl=3PbCl2+Cl2↑+4H2O
A.②③⑤B.②③④C.①②③D.①②④⑤
从海带中提取碘,可经过以下实验步骤完成。下列有关说法正确的是
| A.在灼烧过程中使用的仪器只有酒精灯、三脚架、泥三角、烧杯、玻璃棒 |
B.在上述氧化过程中发生反应的离子方程式为2I-+H2O2 I2+2OH- I2+2OH- |
| C.在提取碘单质时,用酒精作萃取剂 |
| D.在分液时,待下层液体完全流出后,关闭旋塞,上层液体从上口倒出 |
如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是
①CO、O2②C12、CH4③NO2、O2④N2、H2
| A.①② | B.②④ | C.②③ | D.③④ |