过硫酸钾(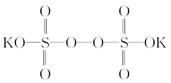 )具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:
)具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下: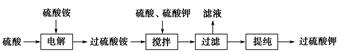
(1)硫酸铵和硫酸配制成电解液,以铂作电极进行电解,生成过硫酸铵溶液。写出电解时发生反应的离子方程式_____________________________________
___________________________________。
(2)已知相关物质的溶解度曲线如右图所示。在实验室中提纯过硫酸钾粗产品的实验具体操作依次为:将过硫酸钾粗产品溶于适量水中,________________,干燥。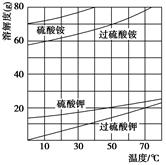
(3)样品中过硫酸钾的含量可用碘量法进行测定。实验步骤如下:
步骤1:称取过硫酸钾样品0.300 0 g于碘量瓶中,加入30 mL水溶解。
步骤2:向溶液中加入4.00 0 g KI固体(略过量),摇匀,在暗处放置30 min。
步骤3:在碘量瓶中加入适量醋酸溶液酸化,以淀粉溶液作指示剂,用0.100 0 mol·L-1Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3标准溶液21.00 mL。
(已知反应:I2+2S2O32-=2I-+S4O62-)
①若步骤2中未将碘量瓶“在暗处放置30 min”,立即进行步骤3,则测定的结果可能________(选填“偏大”、“偏小”、“无影响”);上述步骤3中滴定终点的现象是____________________________________________。
②根据上述步骤可计算出该样品中过硫酸钾的质量分数为_______________。
③为确保实验结果的准确性,你认为还需要____________________________。
(4)将0.40 mol过硫酸钾与0.20 mol硫酸配制成1 L溶液,在80 ℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如图所示(H+浓度未画出)。图中物质X的化学式为________________________。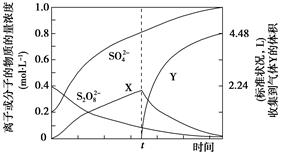
甲醇是一种很好的燃料,工业上可用多种原料通过不同的反应制得甲醇。
(1)已知在常温常压下: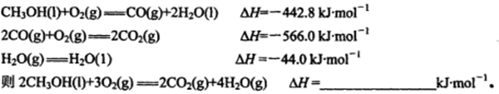
(2)工业上正在研究利用CO2和H2来生产甲醇燃料的方法,该反应为: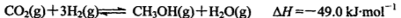
在某温度下,将6mol CO2和8mol H2充入容积为2L的密闭容器中,8分钟时达平衡状态,H2的转化率为75%。请回答:
①用CH3OH表示该反应在0-8min内的平均反应速率v(CH3OH) =.
②此温度下该反应平衡常数K=____________;
③若在上述平衡体系中,再充入2mol H2,反应达到平衡后H2的转化率_________75%(填“大于”、“小于”或“等于”)。
(3)一氧化碳与氢气也可以合成甲醇: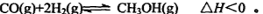
①若该反应在恒温恒容条件下进行,下列说法正确的是;
a.若混合气体的密度不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入CH3OH(g)使压强增大,平衡向右移动
c.反应达到平衡后,通入氩气使压强增大,平衡向右移动
d.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
e.若使用催化剂,会改变反应的途径,但反应的焓变不变
②某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数
K="50" 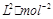 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:
请比较此时正、逆反应速率的大小:v正v逆(填“>”、“<”或“=”)
运用化学反应原理研究元素及其化合物的反应有重要意义。
工业合成氨过程中,N2和H2反应生成NH3:N2(g)+3H2(g)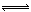 2NH3(g)。混合体系中NH3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2NH3(g)。混合体系中NH3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: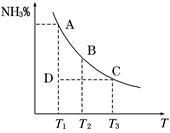
(1)N2(g)+3H2(g) 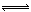 2NH3(g)的ΔH________0(填“>”或“<”)。
2NH3(g)的ΔH________0(填“>”或“<”)。
(2)若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡_______移动(填“向左”、“向右”或“不移动”) 。
(3)若温度为T1时,反应进行到状态D时,v正_____v逆(填“>”、“<”或“=”)。
(4)在体积为5 L的恒温、恒容密闭容器中,起始时投入2 mol N2、3 mol H2,经过10 s达到平衡,测得平衡时NH3的物质的量为0.8 mol。
①达平衡时N2的转化率=________。
②容器中反应的逆反应速率随时间变化的关系如图。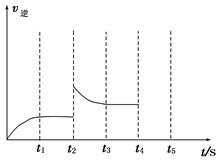
t2时改变了某一种条件,改变的条件可能是__________、____________________(填写两项)。
(14分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜,丙中滴有少量的酚酞试液。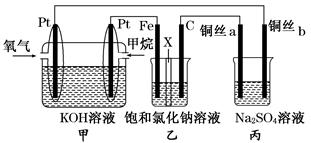
请按要求回答相关问题:
(1)甲烷燃料电池负极电极反应式是:。
(2)石墨电极(C)的电极反应式为______________________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体体积为___ L。
(4)铜丝a处在开始一段时间的现象为______________;原因是________________________________________________________________________。
(5)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是________。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(6)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应为____________________________。
肼(N2H4)是火箭发射常用的燃料。一种以肼(N2H4)为燃料的电池装置如图所示。该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。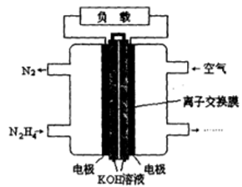
(1)负极上发生的电极反应为_________________;
(2)电池工作时产生的电流从_______电极经过负载后流向________电极(填“左侧”或“右侧”)。
(3)放电一段时间后,右侧溶液的pH (填“变大”或“变小”)
(12分)
Ⅰ.含氯消毒剂可防甲型H1N1流感。二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与Na2SO3反应制得。
(1)请写出反应的离子方程式_________________________________________________。
Ⅱ.某无色溶液只含有下列8种离子中的某几种:Na+、H+、Mg2+、Ag+、Cl-、OH-、HCO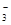 、NO
、NO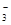 。已知该溶液可与Al2O3反应,则:
。已知该溶液可与Al2O3反应,则:
(2)该溶液与Al2O3反应后有Al3+生成,则原溶液中一定含有_____,一定不会含有大量的________。
(3)该溶液与Al2O3反应后有AlO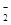 生成,则原溶液中一定含有_______,可能含有大量的________。
生成,则原溶液中一定含有_______,可能含有大量的________。
(4)写出该溶液与Al2O3反应生成AlO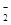 的离子方程式___________________________。
的离子方程式___________________________。