Ba2+是一种重金属离子,有一环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的物质的量浓度。
(1)在容量瓶的使用方法中,下列操作不正确的是(填字母)________。
| A.使用容量瓶前检查它是否漏水 |
| B.容量瓶用水洗净后,再用待配溶液润洗 |
| C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近标线1~2 cm处,用滴管逐滴滴加蒸馏水至标线 |
| D.配制溶液时,若试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加水至接近标线1~2 cm处,用滴管逐滴滴加蒸馏水至标线 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
(2)现需配制250 mL 0.100 mol·L-1的标准Na2S2O3溶液,所需要的玻璃仪器除量筒、250 mL容量瓶、玻璃棒外,还需要________________。
(3)需准确称取Na2S2O3固体的质量为________g。
(4)另取废水50.00 mL,控制适当的酸度,加入足量的K2Cr2O7溶液,得到BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加入过量KI溶液进行反应,然后在反应液中滴加上述标准Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00 mL。已知有关反应的离子方程式为①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;②I2+2S2O32-=2I-+S4O62-。则该工厂废水中Ba2+的物质的量浓度为________。
某中学有甲、乙两个探究性学习小组,他们拟用小颗粒的铝铜合金与足量的稀硫酸反应测定通常状况(约20℃、1.01×105Pa)下的气体摩尔体积(Vm)。
(一)甲组同学拟设计如图1所示的装置来完成实验。
(1)写出装置I中发生反应的离子方程式:。
(2)实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻旋开其活塞,一会儿后发现稀硫酸不能顺利滴入锥形瓶中。请帮助他们分析其原因:。
(3)实验结束时,生成氢气的体积近似等于:。
(4)锥形瓶中残存的氢气对实验结果是否有影响:(填“有”、“没有”、或“不能判断”),简述理由:。
(二)乙组同学仔细分析了甲组同学的实验装置后以为,稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶中的空气排出,使所测氢气的体积偏大;实验结束后,连接广口瓶
和量筒的导管中有少量水存在,使所测氢气的体积偏小。于是他们设计了如图2所示的实验装置。
(1)装置中导管a的作用是:。
(2)实验中准确测定出4个数据,如下表:
| 实验前 |
实验后 |
|
| 铝铜合金质量(g) |
m1 |
m2 |
| 量液管(C)体积(mL) |
V1 |
V2 |
利用上述数据计算通常状况下的气体摩尔体积:Vm=。
(共12分)某同学利用以下装置制备氨气并探究氨气的还原性。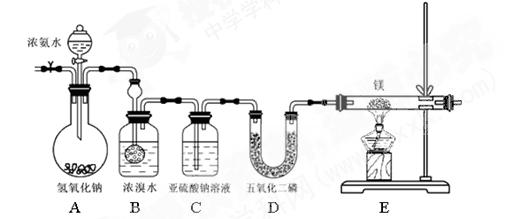
实验步骤及现象:①连接仪器并检验装置气密性②通入惰性气体(不与镁反应),排出装置中的空气③打开分液漏斗活塞,观察到B中浓溴水颜色变浅至褪色,C中产生无色气泡④点燃酒精灯,观察E中固体变成了黄绿色。
查阅资料:氮化镁是黄绿色固体,遇水剧烈反应生成两种碱。
请回答下列问题:
(1)A中氢氧化钠的作用为(用简要的语言和方程式来说明)
(2)写出B处反应的化学方程式
(3)亚硫酸钠的作用
(4)此装置有不足之处,请说明
(5)某同学要继续探究E中固体成分。将E中的固体放入稀盐酸中,观察到固体溶解并产生气泡,写出此过程中反应的化学方程式
Ⅰ.如图所示为常见仪器的部分结构。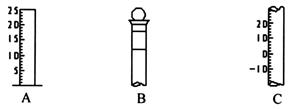
(1)请写出下列仪器的名称:A,B,C。
(2)仪器B上标记有(填序号)。
①质量②温度③刻度线④浓度⑤容积
(3)仪器B使用前必须。
Ⅱ.现用98%的浓H2SO4(密度为1.84g/cm3)来配制480mL0.2mol/L的稀H2SO4。
有关操作为:①计算所需浓硫酸的体积②量取一定体积的浓硫酸③稀释、冷却④转移、洗涤⑤定容⑥摇匀
回答下列问题
(4)应量取的浓硫酸体积是,实验中所用的玻璃仪器除烧杯、玻璃棒、
量筒、胶头滴管外还有;
(5)第③步中稀释浓硫酸的操作是
(6)将所配制的稀H2SO4进行测定,发现实际浓度大于0.2mol/L。请你分析下列哪些操作会引起所配浓度偏大(填写字母)。
| A.用量筒量取浓硫酸时,仰视量筒的刻度 |
| B.容量瓶未干燥即用来配制溶液 |
| C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容 |
| D.往容量瓶转移时,有少量液体溅出 |
E.烧杯未进行洗涤
F.在容量瓶中定容时俯视容量瓶刻度线
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
、某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数 。
。
请回答:(1)以上步骤有错误的是(填编号),
该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) ______;
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无响”)____________;
(3)判断滴定终点的现象是:锥形瓶中溶液从色变为色,且半分钟不变色;
(4)右图是某次滴定时的滴定管中的液面,其读数为mL;
(5)根据下列数据:请计算待测盐酸溶液的浓度:mol/L。
| 滴定次数 |
待测体积(ml) |
标准烧碱体积(ml) |
|
| 滴定前读数 |
滴 定后读数 定后读数 |
||
| 第一次 |
20.00 |
0.40 |
20.40 |
| 第二次 |
20.00 |
4.00 |
24.00 |
| 第三次 |
20.00 |
2.00 |
24.10 |
亚硝酸钠属剧毒物质,是一种食品护色剂。人体摄入过多的亚硝酸钠,30min即出现恶心、呕吐、全身 无力、皮肤青紫等中毒症状,严重者昏迷、抽搐、呼吸衰竭而死亡。我国因亚硝酸钠严重污染或以“工业盐”(亚硝酸钠)作为食盐误食引起恶性食物中毒事故屡有发生。所以 ,在肉制品加工中使用护色剂必须严格控制其使用量,确保食用安全。
(1) 已知NaNO2能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O,反应中氧化剂是_________,若有2mol NaNO2发生反应转移电子的物质的量_________mol。
(2)根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有①自来水②碘化钾淀粉试纸③淀粉④白糖⑤食醋⑥白酒。进行实验时,必须选用的物质有_____________。
(3)若误食亚硝酸盐会导致血红蛋白中亚铁离子转化为铁离子而中毒。服用维生素C可解除亚硝酸盐中毒。下列叙述正确的是_________。
| A.亚硝酸盐是还原剂 | B.维生素C是还原剂 |
| C.维生素C能把亚铁离子氧化为三价铁离子 | D.亚硝酸盐被氧化 |