辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下: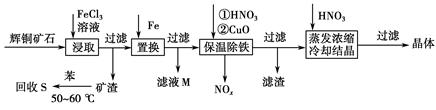
(1)写出浸取过程中Cu2S溶解的离子方程式___________________________。
(2)回收S过程中温度控制在50~60 ℃之间,不宜过高或过低的原因是____________________、____________________。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为______________________;向滤液M中加入(或通入)下列________(填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)保温除铁过程中加入CuO的目的是____________________;蒸发浓缩时,要用硝酸调节溶液的pH,其理由是______________________________。
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示: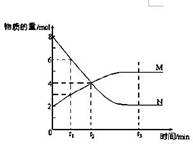
(1)该反应的化学方程式是___________________。
(2)在图上所示的三个时刻中,(填t1、t2或t3)时刻处于平衡状态,此时V正V逆(填>、<或=);达到平衡状态后,平均反应速率v(N)﹕v(M)= 。
(3)若反应容器的容积不变,则压强不再改变(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率
| A.升高温度 | B.降低压强 | C.减小M的浓度 | D.将反应容器体积缩小 |
有机化学中常用18O原子作示踪原子来研究乙酸与乙醇反应生成酯的反应机理,反应过程中酸分子断裂C—O单键,醇分子断裂O—H键。试述书写CH3COOH和CH3CH218OH反应的化学方程式:
已知反应: KClO3 + 6HCl =" KCl" + 3Cl2 + 3H2O ,若用K35ClO3与H37Cl作用,则所得氯气的相对分子质量为 .
A、B、C、D、E都为短周期元素,A是相对原子质量最小的元素;B的+1价阳离子和C的―1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题。
(1)B元素在元素周期表中的位置是第______周期______族。
(2)画出D元素的原子结构示意图____________。
(3)与E的氢化物分子所含电子总数相等的分子是____________(举一例、填化学式,下同)、离子是____________。
(4)A与C形成的化合物中含有化学键的类型是____________。
(5)D的单质与B的最高价氧化物对应的水化物的溶液发生反应的离子方程式为____________________。
已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:C(金刚石、s)+O2(g)=CO2(g);△H=-395.41kJ/mol,C(石墨、s)+O2(g)=CO2(g);△H=-393.51kJ/mol,则金刚石转化石墨时的热化学方程式为:____________________________________。
由此看来更稳定的碳的同素异形体为:____________。若取金刚石和石墨混合晶体共1mol 在O2中完全燃烧,产生热量为QkJ,则金刚石和石墨的物质的量之比为_____________(用含Q的代数式表示)
镁、铝是两种重要的金属,它们的单质及化合物有着各自的性质。
Ⅰ.海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,某同学设计了如下
流程步骤:
主要的步骤总结如下:①把贝壳制成石灰乳②往母液中加石灰乳,沉降、过滤,得到Mg(OH)2沉淀③将沉淀物与盐酸反应,结晶、过滤,将制得的晶体脱水得无水MgCl2
④将得到的产物熔融后电解。
(1)下列说法不正确的是__________________(填代号)
| A.此法的优点之一是原料来源丰富 |
| B.进行①②③步骤的目的是从海水中提取氯化镁 |
| C.第④步电解法制取镁是由于镁是很活泼的金属 |
| D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应 |
(2)步骤②不够合理,理由是
Ⅱ.(1)铝、空气、海水可组成一种电池,广泛用于制造航标灯。此电池正极的电极反应为。
(2)铝热还原法是冶炼熔点较高的金属的一种重要方法,焊接钢轨即用到此法。将干燥的氧化铁粉末和铝粉均匀混合后放入纸漏斗中(漏斗已事先处理好),并架在铁架台上,
下面放置一个盛有沙子的蒸发皿。请写出引发铝热反应的操作及该反应的化学方程式:
操作
化学方程式。
(3)为确定某铝热剂(氧化铁粉末和铝粉)的组成,分别进行下列实验。
若取10.7g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况)体积为3.36L,反应的化学方程式为,样品中铝的质量是g。
若取10.7g样品将其点燃,恰好完全反应,待反应产物冷却后,加入足量盐酸,测得生成的气体体积为aL,该气体与上小题中所得气体的体积比等于∶。