(1)二氧化硫的催化氧化的过程如图所示,
其中a、c二步的化学方程式可表示为:
SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
该反应的催化剂是 (写化学式)
(2)压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
| 压强/MPa 温度/℃ |
0.1[ |
0.5 |
1 |
10 |
| 400 |
99.2% |
99.6% |
99.7% |
99.9% |
| 500 |
93.5% |
96.9% |
97.8% |
99.3% |
| 600 |
73.7% |
85.8% |
89.5% |
96.4% |
当合成SO3的反应达到平衡后,改变某一外界条件(不改变SO2、O2和SO3的量),反应速率与时间的关系如图所示。图中t1 时引起平衡移动的条件可能是 其中表示平衡混合物中SO3的含量最高的一段时间是 。
(3)550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如右图所示。将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。试计算反应2SO3 2SO2+O2 在550 ℃时的平衡常数K= 。
2SO2+O2 在550 ℃时的平衡常数K= 。
反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高温度 B.充入He(g),使体系总压强增大
C.再充入2 mol SO2和1 mol O2 D.再充入1 mol SO2和1 mol O2
(4)SO3溶于水得到硫酸。在25°C下,将x mol·L-1的氨水与y mol·L-1的硫酸等体积混合,反应后溶液中显中性,则c(NH4+) 2 c(SO42-)(填“>”、“<”或“=”);用含x和y的代数式表示出氨水的电离平衡常数 。
某同学拟用粗氧化铜(含少量FeO及不溶于酸的杂质)制取无水氯化铜,流程如图:
(1)步骤①中氧化铜与盐酸反应的离子万程式:___________________。
(2)步骤②中加入H2O2的目的____________________________________,
沉淀II的化学式为_______________________。
(3)已知:
| 氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
| Fe3+ |
1.9 |
3.2 |
| Cu2+ |
4.7 |
6.7 |
| Fe2+ |
7 |
9 |
步骤③中调节pH的最佳范围为____,调节溶液pH的试剂X可以是______________:
a.NaOH b.CuO c.Cu(OH)2 d.
(4)步骤④的操作是___________,过滤、洗涤、干燥。
为得到无水CuCl2,步骤⑤需在干燥的HCl气流中加热 ,原因是__________________________________________________________。
,原因是__________________________________________________________。
咖啡酸(如图)存在于野胡萝卜、光叶水苏、荞麦等物中。咖啡酸有止血作用,特别对内脏的止血效果较好。
(1)咖啡酸的化学式_____________。咖啡酸中含氧官能团的名称________________。
(2)咖啡酸发生加聚反应所得产物的结构简式______________。
(3)下列关于咖啡酸的说法正确的是_____:
| A.1mol咖啡酸最多只能与1molBr2反应 |
| B.咖啡酸和乙醇能发生酯化反应 |
| C.咖啡酸遇氯化铁溶液能发生显色反应 |
| D.只用KMnO4溶液即可检验咖啡酸分子中含有碳碳双键 |
(4)咖啡酸与足量NaOH溶液反应的化学方程式:__________________。
(5)A是咖啡酸的同分异构体,其苯环上只有1个取代基,1molA能与2molNaHCO3反应,A的结构简式_________________________。
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为;砷与溴的第一电离能较大的是。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为,与其互为等电子体的一种分子为。
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为,As原子采取杂化。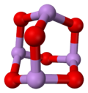
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与
个Ga相连,As与Ga之间存在的化学键有(填字母)。
| A.离子键 | B.σ键 | C.π键 | D.氢键 |
E.配位键 F.金属键
G.极性键
(18分)钛(Ti)被称为继铁、铝之后的第三金属,江西省攀枝花和西昌地区的钒钛磁铁矿储量十分丰富。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白: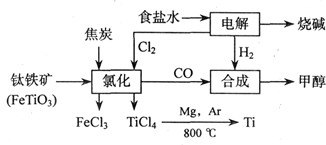
⑴电解食盐水时,总反应的离子方程式_____________________________________。
⑵写出钛铁矿经氯化法得到四氯化钛的化学方程式:___________________。
⑶已知:①Mg(s) +Cl2(g)=MgCl2(s);ΔH=-641 kJ·mol-1
②Ti(s)+2Cl2(g)=TiCl4(s);ΔH=-770 kJ·mol-1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);ΔH____________________
反应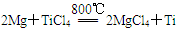 在Ar气氛中进行的理由是____________________。
在Ar气氛中进行的理由是____________________。
⑷在上述产业链中,合成192 t甲醇理论上需额外补充H2__________t(不考虑生产过程中物质的任何损失)。
⑸以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是____________________________________________。
(6)已知2A2(g)+B2(g)  2C3(g);△H="-a" kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
2C3(g);△H="-a" kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
①比较a____________b(填>、=、<)
②此反应的平衡常数表达式为________________________;若将反应温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)
③能说明该反应已经达到平衡状态的是______。
| A.v(C3)=2v(B2) | B.容器内压强保持不变 |
| C.v逆(A2)=2v正(B2) | D.容器内的密度保持不变 |
(12分)以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。
回答以下问题:
⑴该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=________mol·L-1。
⑵写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]= ________,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,c(AsO43-)的最大是 ___mol·L-1。
⑶工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式。
⑷在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 __;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为 _____。