由Cu、N、B等元素组成的新型材料有着广泛用途。
(1)基态 Cu+ 的核外电子排布式为 。在高温下CuO能分解生成Cu2O,试从原子结构角度解释其原因: 。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于 晶体。
(3)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过3CH4 + 2 (HB=NH)3 + 6H2O →3CO2 + 6H3BNH3制得。
①与上述化学方程式有关的叙述不正确的是 (填标号)。
| A.反应前后碳原子的轨道杂化类型不变 |
| B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
| C.第一电离能:N>O>C>B |
| D.化合物A中存在配位键 |
②1个 (HB=NH)3分子中有 个σ键。
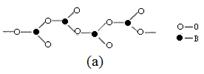
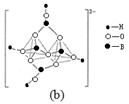
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为 。图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为 。
同温同压下,有0.3molO2与0.2molO3,它们的质量之比为,它们所含的原子数之比为,它们的体积之比为,它们的密度之比为。
(共12分)现有下列种物质:① CH3OH②
③ ④
④ ⑤
⑤
(1)能发生消去反应生成烯烃的是(请填序号,下同),其消去产物依次是;由此可以推出苯甲醇( )(填“能”或“不能”)发生消去反应。
)(填“能”或“不能”)发生消去反应。
(2)能在铜的催化作用下,被空气中氧气氧化成醛的序号分别是,请写出能被氧化成酮的反应方程式:
某烃类化合物A的用仪器可以测出其相对分子质量为84,分子中含有碳碳双键,分子中只有一种类型的氢。
(1)现有以下的实验室仪器:
| A.1H核磁共振仪 | B.质谱仪 | C.红外光谱仪 | D.元素分析仪 |
请你选择分别用什么仪器。①测出相对分子质量 (填字母代号,下同)、
②测出官能团碳碳双键、③测出几种类型的氢。
(2)结合题给信息,可以判断A的结构简式为;
A中的的碳原子是以什么形式杂化?;
(3)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。
反应②的化学方程式为 ;
C的名称为;反应类型为;。
E2的结构简式是;④、⑤的反应类型依次是
 、
、
Ⅰ、请分析下列各组物质,用序号填写出它们的对应关系:
①碳架异构、②官能团位置异构、③官能团类别异构、④顺反异构、⑤对映异构、⑥同一物质(填序号)
(1)C2H5OH和CH3OCH3
(2) 和
和
(3) 和
和
(4) 和
和
(5) 和
和
(6) 和
和
Ⅱ、请按系统命名法命名下列有机物:
(1) (2)
(2)
Ⅲ、请按以下要求进行填空:
(1)下列属于苯的同系物的是 (填字母符号,下同)
|
A. B.
B. C.
C. D.
D.
 B.
B. C.
C. D.
D.
某芳香烃衍生物的分子式为C7H8O,根据下列实验现象,确定结构简式。
(1)若该有机物遇FeCl3溶液显色,则其可能的结构简式为:
,,。
上述的三种物质中,苯环上的一氯代物种类最少的一氯代烃有种,最多的一氯代烃有种。
(2)若该有机物不能与金属钠反应产生氢气,则结构中会有(填官能团)出现。
(3)若该有机物遇FeCl3溶液不显色,但与金属钠反应放出H2,则其反应的化学方程式为
。