2012年8月24日,武汉市一家有色金属制造厂发生氨气泄露事故。已知在一定温度下,合成氨工业原料气H2制备涉及下面的两个反应:
C(s)+H2O(g) CO(g)+H2(g);
CO(g)+H2(g);
CO(g)+H2O(g) H2(g)+CO2(g)。
H2(g)+CO2(g)。
(1)判断反应CO(g)+H2O(g) CO2(g)+H2(g)达到化学平衡状态的依据是________。(多选、漏选、错选均不得分)
CO2(g)+H2(g)达到化学平衡状态的依据是________。(多选、漏选、错选均不得分)
A.容器内压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(2)在2 L定容密闭容器中通入1 mol N2(g)和3 mol H2(g),发生反应:3H2(g)+N2(g)  2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
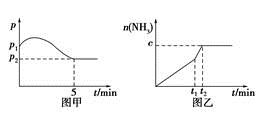
①若图中c=1.6 mol,则改变的条件是________(填字母);
②若图中c<1.6 mol,则改变的条件是__________(填字母);此时该反应的平衡常数____________。(填字母)(填“增大”、“减小”、“不变”)
A.升温
B.降温
C.加压
D.减压
E.加催化剂
(3)如(2)题中图甲,平衡时氢气的转化率为________。
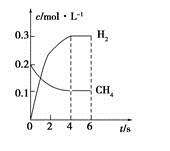
(4)工业上可利用如下反应:H2O (g)+CH4 (g) CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如右图所示:0~4 s内,用CO(g)表示的反应速率为____________。
CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如右图所示:0~4 s内,用CO(g)表示的反应速率为____________。
以对甲酚(A)为起始原料,通过一系列反应合成有机物E的路线如下: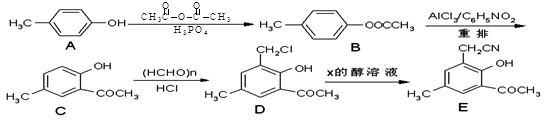
(1)A→B的反应类型为 。
(2)C的核磁共振氢谱有 个峰。
(3)D→E发生的取代反应中还生成了NaCl,则X的化学式为 。
(4)写出同时满足下列条件的D的同分异构体的结构简式: (任写一种)。
①苯的衍生物,苯环上有四个取代基且苯环上的一取代产物只有一种
②与Na2CO3溶液反应放出气体
(5)已知:R-CN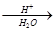 R-COOH,E在酸性条件下水解后的产物在一定条件下可生成F(C11H10O3)。写出F的结构简式: 。
R-COOH,E在酸性条件下水解后的产物在一定条件下可生成F(C11H10O3)。写出F的结构简式: 。
(6)利用合成E路线中的有关信息,写出以对甲酚、乙醇为主要原料制备 的合成路线流程图。
的合成路线流程图。
流程图示例如下: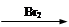 CH3CH2OH
CH3CH2OH 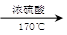 H2C=CH2 BrH2C-CH2Br
H2C=CH2 BrH2C-CH2Br
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
CH4(g)+H2O(g) ===CO(g)+3H2(g) ΔH=+206.2 kJ/mol
CH4(g)+CO2(g) ===2CO(g)+2H2(g) ΔH=+247.4 kJ/mol
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为。
(2)硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。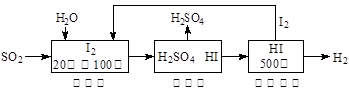
已知1g FeS2完全燃烧放出7.1 kJ热量,FeS2燃烧反应的热化学方程式为。
该循环工艺过程的总反应方程式为。
(3)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为。
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH Ni(OH)2+M
Ni(OH)2+M
①电池放电时,正极的电极反应式为。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为。
(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为。
布噁布洛芬是一种消炎镇痛的药物。它的工业合成路线如下:
请回答下列问题:
(1)A长期暴露在空气中会变质,其原因是。
(2)A到B的反应通常在低温时进行。温度升高时,多硝基取代副产物会增多。下列二硝基取代物中,最可能生成的是。(填字母)
a.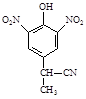 b.
b.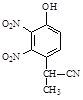 c.
c.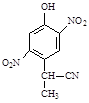 d.
d.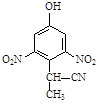
(3)在E的下列同分异构体中,含有手性碳原子的分子是。(填字母)
a.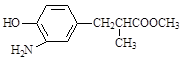
b.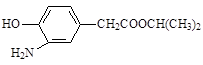
c.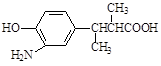
d.
(4)F的结构简式。
(5)D的同分异构体H是一种α-氨基酸,H可被酸性KMnO4溶液氧化成对苯二甲酸,则H的结构简式是 。高聚物L由H通过肽键连接而成,L的结构简式是 。
化合物A经过下列反应后得到一种六元环状酯G。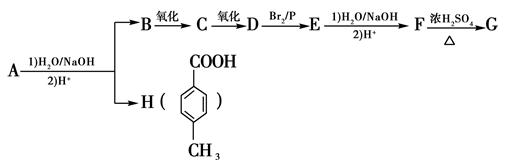
已知F的分子式是C4H8O3,F的核磁共振氢谱显示共有三个峰。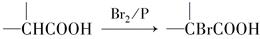
请回答下列问题:
(1) A、B的结构简式分别为、。
(2) 写出F→G反应的化学方程式:。
(3)写出满足下列条件的H的一种同分异构体的结构简式:。
①是苯的对位二取代物;②不能与FeCl3溶液发生显色反应;③不考虑烯醇 (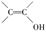 )结构。
)结构。
(4)在G的粗产物中,经检测含有聚合物杂质。写出聚合物杂质可能的结构简式(仅要求写出1种):,形成该聚合物的反应类型为:。
普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出空间构型)。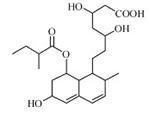
试填空:
(1)该有机物分子中的含氧官能团是。(填名称)
(2)该有机物的分子式为。
(3)该有机物能发生反应。(请填序号)
a.取代反应 b.消去反应 c.加成反应
(4)1 mol该有机物与足量的氢氧化钠溶液充分反应,需要消耗氢氧化钠mol。