下列实验过程中出现的异常情况,其可能原因分析错误的是( )。
| 选项 |
异常情况 |
可能原因分析 |
| A |
蒸发结晶:蒸发皿破裂 |
将溶液蒸干或酒精灯灯芯碰到热的蒸发皿底部 |
| B |
分液:分液漏斗中的液体难以滴下 |
没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐 |
| C |
蒸馏:冷凝管破裂 |
冷凝管没有通水或先加热后通水 |
| D |
萃取:液体静置不分层 |
加入萃取剂的量较多 |
能正确表示下列反应的离子方程式的是
| A.Cl2通入NaOH溶液:Cl2+OH-===Cl-+ClO-+H2O |
| B.稀盐酸溶液中加入CaCO3:CO32-+2H+===CO2↑+H2O |
| C.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O===AlO2-+4NH4++2H2O |
| D.Cu溶于稀HNO3:3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O |
下列各组离子能在指定溶液中大量共存的是
①无色溶液中:K+、Cl-、Na+、MnO4-、NO3-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-、S2-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
| A.①② | B.①③ | C.②④ | D.③④ |
设NA为阿伏伽德罗常数的值,下列说法正确的是
| A.1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| B.常温下,0.1mol/L NH4NO3溶液中NO3-的数目为0.1NA |
| C.标准状况下,11.2L CCl4中含有分子的数目为0.5NA |
| D.室温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
下列关于物质应用和组成的说法正确的是
| A.P2O5可用于干燥Cl2和NH3 |
| B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 |
| C.CCl4不可用于鉴别溴水和碘水 |
| D.Si和SiO2都用于制造光导纤维 |
某实验小组利用粗硅与氯气反应生成SiCl4粗产品(含有FeCl3、AlCl3等杂质且SiCl4遇水极易水解),蒸馏得四氯化硅(SiCl4的沸点57.7℃),再用氢气还原制得高纯硅;用滴定法测定蒸馏后残留物(将残留物预处理成Fe2+)中铁元素含量。采取的主要操作如图,能达到实验目的是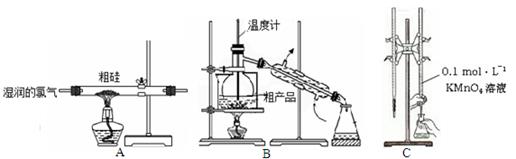
| A.用装置A完成SiCl4的制备 |
| B.用装置B进行蒸馏提纯SiCl4 |
| C.用装置C进行滴定达终点时现象是:锥形瓶内溶液变为紫红色且半分钟内不变色 |
| D.配制0.1 mol·L—1 KMnO4溶液定容摇匀后,发现液面低于刻度线,加水至刻度线 |