有关晶体的结构如图所示,下列说法中不正确的是 ( )。
| A.在NaCl晶体(图甲)中,距Na+最近的Cl-形成正八面体 |
| B.该气态团簇分子(图乙)的分子式为EF或FE |
| C.在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻 |
| D.在碘晶体(图丁)中,碘分子的排列有两种不同的方向 |
在室温度下,1 L某溶液中含有的离子如下表:
| 离子 |
Cu2+ |
Al3+ |
NO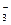 |
Cl- |
| 物质的量浓度(mol/L) |
1 |
1 |
4 |
a |
用惰性电极电解该溶液,当电路中有3 mol e―通过时(忽视电解时溶液体积的变化及电极产物可能存在的溶解现象),下列说法正确的是
| A.电解后溶液的pH=" 0" | B.阳极与阴极析出的气体物质的量之比为1:2 |
| C.阳极电极反应:2Cl——2e—=Cl2 | D.阴极析出32g铜 |
下列离子方程式正确的是
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O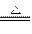 Fe(OH)3↓+3H+ Fe(OH)3↓+3H+ |
| B.向小苏打溶液中加入过量的石灰水:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| C.向硫酸氢钠溶液中加入氢氧化钡使溶液呈中性:Ba2++OH-+H++SO42-= BaSO4↓+H2O |
| D.用食醋除去水壶中的水垢:CaCO3+2H+=Ca2++CO2↑+H2O |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.300 mL2 mol·L-1蔗糖溶液中所含分子数为0.6NA |
| B.含1mol H2O的冰中,氢键的数目为4NA |
| C.在1mol的CH3+(碳正离子)中,所含的电子数为9 NA |
| D.7g CnH2n中含有的氢原子数目为NA |
下列实验不能达到预期目的的是
| A.除去乙酸乙酯中混有的少量乙酸:加入乙醇和浓硫酸,加热、静置、分液 |
| B.浓、稀HNO3分别与Cu反应,比较浓、稀HNO3的氧化性强弱 |
| C.测定等浓度的Na3PO4、Na2SO4两溶液的pH比较磷、硫的非金属性强弱 |
| D.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤 |
向100 g FeCl3溶液中放入一小块钠,待反应完全后,过滤,得到仍有棕黄色的溶液91.8g,则投入钠的质量为()
| A.18.4g | B.13.8g | C.8.2g | D.9.2g |