二氧化锰可用作干电池去极剂,合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
(1)二氧化锰在酸性介质中是一种强氧化剂,请用化学方程式证明:______________________。
(2)锌—锰碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。电池的总反应式为Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。
①电池工作时,MnO2发生________反应。
②电池的正极反应式为________。
(3)工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下: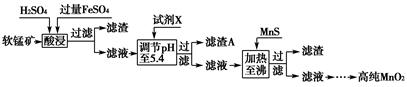
已知:软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表。
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
| pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
| 沉淀物 |
Zn(OH)2 |
CuS |
ZnS |
MnS |
FeS |
| pH |
8.0 |
-0.42 |
2.5 |
7 |
7 |
回答下列问题:
①硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为________________________。
②试剂X为________。
③滤渣A的主要成分为________。
④加入MnS的目的主要是除去溶液中的________。
切开的金属Na暴露在空气中,其变化过程如下:
(1)反应Ⅰ的反应过程与能量变化的关系如下:
① 反应Ⅰ 是 反应(填“放热”或“吸热”),判断依据是 。
② 1 mol Na(s)全部氧化成Na2O(s)的热化学方程式是 。
(2)反应Ⅱ是Na2O与水的反应,其产物的电子式是。
(3)白色粉末为Na2CO3。将其溶于水配制为0.1 mol/L Na2CO3溶液,下列说法正确的是(填字母)。
| A.升高温度,溶液的pH降低 |
| B.c(OH-)-c (H+)=c (HCO3-)+2 c (H2CO3) |
| C.加入少量NaOH固体,c (CO32―)与c (Na+)均增大 |
| D.c (Na+) > c (CO32―) > c (HCO3―) > c(OH―) > c (H+) |
(4) 钠电池的研究开发在一定程度上可缓和因锂资源短缺引发的电池发展受限问题。
① 钠比锂活泼,用原子结构解释原因_______。
②ZEBRA 电池是一种钠电池,总反应为NiCl2 + 2Na  Ni + 2NaCl。其正极反应式是_____。
Ni + 2NaCl。其正极反应式是_____。
聚乙烯醇肉桂酸酯(A)可用于光刻工艺中做抗腐蚀涂层。下面是一种合成该有机物的路线: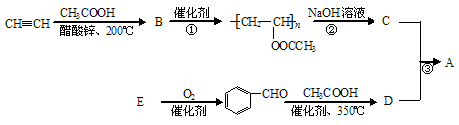
已知: 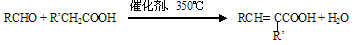
请回答:
(1)CH3COOH中的含氧官能团的名称为;其电离方程式是______。
(2)反应①是加聚反应,B的结构简式是。
(3)反应②的反应类型是。
(4)E的分子式为C7H8O,符合下列条件的E的同分异构体的结构简式是。
① 能与浓溴水反应产生白色沉淀②核磁共振氢谱有4种峰
(5) 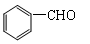 能与新制的Cu(OH)2反应,该反应的化学方程式是。
能与新制的Cu(OH)2反应,该反应的化学方程式是。
(6)关于D的性质下列说法正确的是(填字母)。
a.存在顺反异构
b.溶液呈酸性,能与Na和NaOH溶液反应
c.能使KMnO4(H+)溶液和Br2(CCl4)溶液褪色
d.能发生银镜反应、酯化反应、加成反应和消去反应
(7)反应③的化学方程式是。
某化学小组用下图装置电解CuCl2溶液制少量漂白液: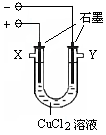

(1)其阳极的反应式是:;导气管W端应与出气口连接。
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质。
查阅资料显示:
| 物质名称及化学式 |
氯化亚铜CuCl |
碱式氯化铜Cu2( OH)3Cl |
| 性质 |
白色固体、不溶水 |
绿色固体、不溶水 |
化学小组分析提出:①红色物质可能有、或Cu2O、或二者都有;②白色物质为CuCl
(3)为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:
取出阴极碳棒,洗涤、干燥、称其质量为W1g ,并将其放入下图所示装置b中,
进行实验。实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g 。
①碳棒上的红色物质是,无水硫酸铜的作用是;
②d中反应的离子方程式是;
③装置b中发生反应的化学方程式是。
④电解CuCl2溶液时,阴极上产生白色物质的原因用电极反应式解释为。
⑤阴极上产生白色物质的物质的量是;若装置b冷却时不继续通H2,则计算所得Cu+的产率会(偏大、偏小、不变)。
氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品及精制的流程:
已知:Br2是易挥发、深红棕色的液体;氢溴酸是易挥发、无色液体。
根据上述流程回答下列问题:
(1)反应室①中发生反应的化学方程式为。
(2)反应室①使用冰水的目的。
(3)操作I的名称,操作Ⅱ用到的玻璃仪器有。
(4)反应室②中加入Na2SO3的目的是。
(5)工业生产中制得的氢溴酸带有淡淡的黄色。于是甲乙两同学设计了实验加以探究:
①甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为 ,若假设成立可观察到的现象为。
②乙同学假设工业氢溴酸呈淡黄色是因为,其用于证明该假设成立的方法为 。
大气中可吸入颗粒物PM2.5主要来源为燃煤、机动车尾气等。
(1)若取某PM2.5样本,用蒸馏水处理,测得溶液中含有的离子有:K+、Na+、NH4+、SO42-、NO3-、Cl-,则该溶液为(填“酸性”或“碱性”)溶液,其原因用离子方程式解释是:。
(2)“洗涤”燃煤烟气可减轻PM2.5中SO2的危害,下列可适用于吸收SO2的试剂有
A.CaCl2溶液 B.氨水 C.Ca(OH)2悬浊液 D.浓H2SO4
(3)煤烟气中的氮氧化物可用CH4催化还原成无害物质。若常温下,1molNO2与CH4反应,放出477.5kJ热量,该反应的热化学方程式是 。
(4)安装汽车尾气催化转化器也可减轻PM2.5的危害,其反应是:
2NO(g) + 2CO(g)  2CO2(g)+ N2(g);△H<0。
2CO2(g)+ N2(g);△H<0。
①该反应平衡常数表达式K= ;温度升高K值(填“增大”或“减小” )
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是。
(5)使用锂离子电池为动力汽车,可减少有害气体的排放。锰酸锂离子蓄电池的反应式为: Li1-xMnO4 + LixC
Li1-xMnO4 + LixC LiMnO4 + C
LiMnO4 + C
下列有关说法正确的是
A.充电时电池内部Li+向正极移动
B.放电过程中,电能转化为化学能
C.放电时电池的正极反应式为:Li1-xMnO4+xe—+xLi+=LiMnO4
D.充电时电池的正极应与外接电源的负极相连