X、Y、Z、W是原子序数依次增大的四种短周期元素。X与W可形成四面体形的共价化合物,该化合物常用作灭火剂。Y的次外层电子数等于其最外层和最内层电子数之和的2倍,Y、Z的最外层电子数之和等于W的最外层电子数。
(1)用化学符号表示X的一种核素 。
(2)写出Y的单质与X的最高价氧化物反应的化学方程式 。
(3)Z的单质在W的单质中燃烧,生成的产物中各原子的最外层均达到8电子稳定结构的分子为 。
(4)用电子式表示Y与W形成化合物的过程为 。
(5)XW4的电子式为 。
(6)W的氢化物R是实验室一种常用试剂的主要成分,该试剂可用于实验室多种气体的制备,写出实验室制取气体时满足下列条件的离子方程式。
①R作氧化剂: 。
②R作还原剂: 。
【化学---化学与技术】工业上以黄铁矿为原料,采用接触法生产硫酸。
(1)在炉气制造中,生成SO2的化学方程式为__________________。
(2)炉气精制的作用是将含SO2的炉气_______________、_______________及干燥,如果炉气不经过精制,对SO2催化氧化的影响是 _________________。
(3)精制炉气(含SO2体积分数为7%、O2为ll%、N2为82%)中SO2平衡转化率与温度及压强关系如图所示。在实际生产中,SO2催化氧化反应的条件选择常压、450 ℃左右(对应图中A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是___________、___________。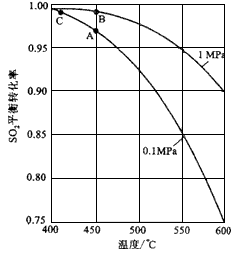
(4)在SO2催化氧化设备中设置热交换器的目的是_________、________,从而充分利用能源。
【化学一一选修有机化学基础】(15分)从有机物A开始有如图所示的转化关系(部分产物略去)。A在NaOH溶液中水解生成B、C和D,1 mol F与足量的新制Cu(OH)2碱性悬浊液加热充分反应可生成2 mol红色沉淀。分析并回答问题: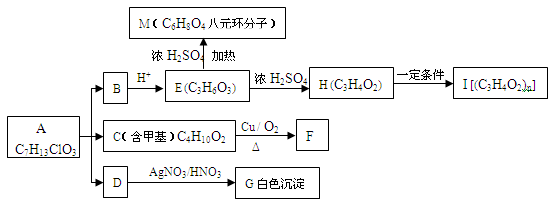
(1)A中含有的官能团名称为氯原子和、;
(2)指出反应类型:
A B、C、D;
B、C、D;
H I;
I;
(3)写出B的分子式:___________________I的结构简式:____________________
(4)写出下列反应的化学方程式:
①C F:;
F:;
②E M:;
M:;
(5)与E含有相同官能团的某有机物甲(C4H8O3)有多种同分异构体,在结构中含有酯基和羟基,且水解产物不存在两个羟基连在同一个碳上的同分异构体有种。
【化学——选修2:化学与技术】(15分)将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺流程提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是________(填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁等的提取工艺
(2)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收。溴歧化为Br-和BrO3-并没有产生CO2则反应的离子反应方程式为。
(3)海水提镁的一段工艺流程如下图:
浓海水的主要成分如下:
| 离子 |
Na+ |
Mg2+ |
Cl- |
SO42- |
| 浓度/(g·L-1) |
63.7 |
28.8 |
144.6 |
46.4 |
该工艺过程中,脱硫阶段主要反应的阳离子_______,获得产品2的离子反应方程式为,浓海水的利用率为90%,则1 L浓海水最多可得到产品2的质量为________g。
(4)由MgCl2·6H2O制备MgCl2时,往往在HCl的气体氛围中加热。其目的是。
二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上以CO和H2为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
①CO(g) + 2H2(g) CH3OH(g) △H1=-Q1 kJ·mol-1
CH3OH(g) △H1=-Q1 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+ H2O(g) △H2=-Q2 kJ·mol-1
CH3OCH3(g)+ H2O(g) △H2=-Q2 kJ·mol-1
③CO(g)+ H2O(g) CO2(g) + H2(g) △H3=-Q3 kJ·mol-1
CO2(g) + H2(g) △H3=-Q3 kJ·mol-1
回答下列问题:
(1)新工艺的总反应3H2(g)+ 3CO(g) CH3OCH3(g)+ CO2(g)的热化学方程式为。
CH3OCH3(g)+ CO2(g)的热化学方程式为。
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g) + 2H2(g) CH3OH (g) △H。下表所列数据是该反应在不同温度下的化学平衡常数(Κ)。
CH3OH (g) △H。下表所列数据是该反应在不同温度下的化学平衡常数(Κ)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
①由表中数据判断ΔH0 (填“ >”、“=”或“<”)。能够说明某温度下该反应是平衡状态的是。
A.体系的压强不变 B.密度不变
C.混合气体的相对分子质量不变 D.c(CO)=c(CH3OH)
②某温度下,将 2mol CO和 6mol H2充入2L的密闭容器中,充分反应 10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=。
(3)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g) 2NH3(g)ΔH=-92.4kJ•mol-1。实验室模拟化工生产,在恒容密闭容器中充入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如图1。请回答下列问题:
2NH3(g)ΔH=-92.4kJ•mol-1。实验室模拟化工生产,在恒容密闭容器中充入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如图1。请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为。
②在实验Ⅲ中改变条件为采用比实验Ⅰ更高的温度,请在图2中画出实验Ⅰ和实验Ⅲ中c(NH3)随时间变化的示意图。
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Ag+、Na+ |
| 阴离子 |
NO3-、SO42-、Cl- |
下图Ⅰ所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了27 g。常温下各烧杯中溶液的pH与电解时间t的关系如下图Ⅱ所示。据此回答下列问题:
(1)M为电源的________(填“正”或“负”)极,乙中阳离子向(填“c”或“d”)定向移动,A是________(填写化学式)。
(2)计算电极f上生成的气体在标准状况下的体积为。
(3)b电极上发生的电极反应为;
乙烧杯的电解池总反应的化学方程式为_________________________________。
(4)要使丙恢复到原来的状态,应加入物质的质量为。