已知:+2
 +2。相关物质的溶度积常数见下表:
+2。相关物质的溶度积常数见下表:
| 物质 |
||||
| 2.2×10-20 |
2.6×10-39 |
1.7×10-7 |
1.3×10-12 |
(1)某酸性溶液中含有少量的,为得到纯净的晶体,加入调至=4,使溶液中的转化为沉淀,此时溶液中的=;
过滤后,将所得滤液低温蒸发、浓缩结晶,可得到晶体。
(2)在空气中直接加热晶体得不到纯的无水,原因是。(用化学方程式表示)。由晶体得到纯的无水的合理方法是。
(3)某学习小组用"间接碘量法"测定含有晶体的试样(不含能与I―发生反应的氧化性质杂质)的纯度,过程如下:取0.36 试样溶于水,加入过量固体,充分反应,生成白色沉淀。用0.1000 标准溶液滴定,到达滴定终点时,消耗标准溶液20.00 。
①可选用作滴定指示荆,滴定终点的现象是。
②溶液与反应的离子方程式为。
③该试样中的质量百分数为.
根据物质相似性、特殊性来学习元素性质是常见的学习方法。
(1)铍(Be)与铝元素相似,其氧化物及氢氧化物具有两性,请写出BeO与盐酸反应的离子方程式_____,Be(OH)2溶于NaOH溶液的化学方程式为:Be(OH)2+2NaOH=Na2 BeO2+2H2 O,往10.0mL1.00mol·L-1的Be(NO3)2溶液中逐滴加入等浓度的NaOH溶液,请在以下坐标图中画出沉淀量随NaOH溶液加人量的变化图: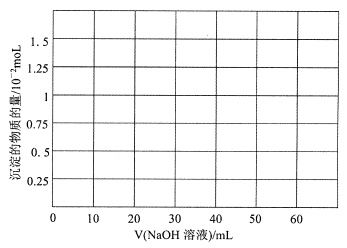
(2)锗与硅元素相似,锗也是良好的半导体,以下是工业冶炼锗的简单流程图:
①GeCl4的晶体类型为__________。
②写出过程III发生反应的化学方程式__________。
③以下有关工业冶炼锗的说法正确的是__________。
| A.GeO2与SiO2性质相似,均易与盐酸反应 |
| B.过程II的蒸馏是利用GeCl4难溶于水的性质实现的 |
| C.过程IV发生的反应中,GeO2作氧化剂 |
| D.上述过程涉及的基本反应类型有复分解反应、置换反应 |
(3)某同学为了探究硫与浓硝酸的反应产物,将硫与浓硝酸混合,结果生成一种纯净无色气体A,A遇空气变红棕色,据此写出硫与浓硝酸反应的化学方程式___________________。
LiAlH4由Li+、A1H4一构成,是有机合成中常用的还原剂。
(1)Al元素在周期表的位置是第__________周期__________族。
(2)比较离子半径大小:Li+__________ H一(选填“>"、“<”或“=”)。
(3)LiAlH4中含有的化学键类型为____________________________________。
(4)LiAlH4中氢元素的化合价为__________,它与水反应生成的单质气体为__________。
(5)LiCl溶液显酸性,用离子方程式说明原因____________________________________。
(6)如图所示,已知75%A的水溶液常用于医疗消毒,则A的结构简式为__________;CH3COOH与A在浓硫酸催化下生成B的有机反应类型为__________。
工业上用重晶石(BaSO4)制备其他钡盐的常用方法主要有高温煅烧还原法、沉淀转化法等。
I.高温煅烧还原法
工业上利用重晶石高温煅烧还原法制备BaCl2的工艺流程图如下:
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得:
BaSO4(s) + 4C(s)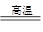 4CO(g) + BaS(s)△H1 =" +" 571.2 kJ·mol-1①
4CO(g) + BaS(s)△H1 =" +" 571.2 kJ·mol-1①
BaSO4(s) + 2C(s)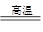 2CO2(g) + BaS(s)△H2 =" +" 226.2 kJ·mol-1②
2CO2(g) + BaS(s)△H2 =" +" 226.2 kJ·mol-1②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为:。
(2)反应C(s) + CO2(g)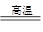 2CO(g)的△H=kJ·mol-1。
2CO(g)的△H=kJ·mol-1。
(3)实际生产中必须加入过量的炭,同时还要通入空气,其目的可能是。
II.沉淀转化法
(4)已知KSP(BaSO4) =1.0×10-10,KSP(BaCO3)=2.5×10-9。某同学设想用饱和Na2CO3溶液和盐酸将BaSO4转化成BaCl2,若用10 L Na2CO3溶液一次性溶解并完全转化1.0 mol BaSO4(溶液体积变化可忽略不计), 则该转化过程的离子方程式为; 反应的平衡常数K=;Na2CO3溶液的最初浓度不得低于。
硝酸铝是重要的化工原料。
(1)在实验室中,硝酸铝必须与可燃物分开存放,是因为硝酸铝具有。
A.可燃性 B.氧化性 C.还原性
(2)用Al作电极电解HNO3溶液制取Al(NO3)3,电解反应的离子方程式为。
(3)查资料得知:当Al(NO3)3溶液pH>3时,铝元素有多种存在形态,如Al3+、[Al(OH)]2+、[Al(OH)2]+等。写出[Al(OH)]2+转化为[Al(OH)2]+的离子方程式。
(4)用硝酸铝溶液(加入分散剂)制备纳米氧化铝粉体的一种工艺流程如下。
①(CH2)6N4水溶液显碱性。请补充完整下列离子方程式。
②经搅拌Ⅱ,pH下降的原因是。
③凝胶中含有的硝酸盐是。
(Ksp[Al(OH)3] =1.3×10-33 ;溶液中离子浓度小于1×10-5 mol·L-1时,可认为这种离子在溶液中不存在)
④煅烧过程主要发生如下转化:  。
。
煅烧过程中样品的失重率(TG%)随温度变化如图。凝胶煅烧失重曲线有明显的三个阶段:
(i)a~b段:失重率82.12%;
(ii)b~c段:失重率9.37%;
(iii)c~d段:失重率几乎为0;
转化Ⅱ对应的失重阶段是(填序号),转化Ⅲ开始的温度是。
(1)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液中,设由水电离产生的OH-的物质的量浓度分别为A和B,则A________B(填“>”、“=”或“<”)。
(2)在纯碱溶液中滴入酚酞,溶液变红色,若向该溶液中再滴入过量的BaCl2溶液,所观察到的现象是_________________________,其原因是_________________________。
(3)对于盐AmBn的溶液:①若为强酸弱碱盐,其水解的离子方程式是_______________。
②若为弱酸强碱盐,其第一步水解的离子方程式是___________________________。