向100 mL 0.1 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是( )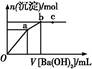
| A.a点时溶液中所含主要溶质为(NH4)2SO4 |
B.a→b段发生反应的离子方程式是:S +Ba2+ +Ba2+ BaSO4↓ BaSO4↓ |
| C.b点为最大沉淀量,对应的纵坐标值为0.02 |
| D.c点加入Ba(OH)2溶液的体积为200 Ml |
在18 ℃时,H2SO3的K1=1.5×10-2、K2=5.0×10-7,H2CO3的K1=1.4×10-7、K2=2.7×10-11,则下列说法中正确的是 ( )
| A.多元弱酸的酸性主要由第一步电离决定,亚硫酸的酸性弱于碳酸 |
| B.多元弱酸的酸性主要由第二步电离决定,碳酸的酸性弱于亚硫酸 |
| C.多元弱酸的酸性主要由第一步电离决定,亚硫酸的酸性强于碳酸 |
| D.多元弱酸的酸性主要由第二步电离决定,碳酸的酸性强于亚硫酸 |
下列离子方程式正确的是( )
A.碳酸氢钠水解:HCO3-+ H2O H3O+ + CO32- H3O+ + CO32- |
B.醋酸铵溶于水:CH3COONH4 + H2O CH3COOH + NH3·H2O CH3COOH + NH3·H2O |
| C.硫酸氢钠溶液中滴入氢氧化钡溶液呈中性:H++ SO42-+ Ba2++OH-=BaSO4↓+ H2O |
D.硫酸钙悬浊液中加入碳酸钠:CaSO4(s) + CO32-(aq) CaCO3(s) + SO42-(aq) CaCO3(s) + SO42-(aq) |
下列液体均处于25 ℃,有关叙述正确的是()。
| A.某物质溶液的pH>7,则该物质一定是碱或强碱弱酸盐 |
| B.pH=6.5的牛奶中c(H+)是pH=4.5的H2SO4溶液中c(H+)的100倍 |
| C.pH=3的醋酸与pH=11的NaOH溶液等体积混合后溶液中: c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D.AgCl在等浓度的CaCl2溶液和NaCl溶液中的溶解度相同 |
某浓度的氨水中存在下列平衡:NH3·H2O NH4+ + OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是()
NH4+ + OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是()
| A.适当升高温度 | B.加入水 | C.通入NH3 | D.加入少量盐酸 |
向20 mL 0.5 mol·L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中错误的是()
| A.醋酸的电离平衡常数:B点>A点 |
| B.由水电离出的c(OH-):B点>C点 |
| C.从A点到B点,混合溶液中可能存在:c(CH3COO-)=c(Na+) |
| D.从B点到C点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |