原子序数小于36的X、Y、Z、W四种元素,元素X的原子核外最外层电子数是内层电子数的2倍,元素Y与X同周期,其基态原子占据s轨道的电子数与占据p轨道的电子数相同,Z是X的同族相邻元素;W是第Ⅷ族元素中原子序数最小的元素。用元素符号回答下列问题:
(1)X、Y、Z的电负性由小到大的顺序是 。 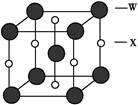
(2)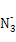 与X、Y形成的一种化合物互为等电子体,则
与X、Y形成的一种化合物互为等电子体,则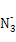 的空间构型为 、电子式为 。
的空间构型为 、电子式为 。
(3)同为原子晶体的ZX与ZY2中硬度小的是 。
(4)X和W所形成的某种晶体结构如图所示,写出:
①基态W2+的价电子排布式 ;
②该晶体的化学式 。
如图为四、五、六、七主族元素简单氢化物沸点随周期变化图像,(代表氢化A、B、C、D物中另外一种元素)分析图像并回答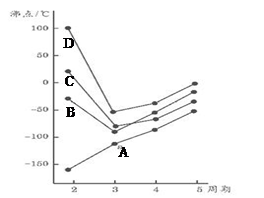
(1)写出B3-的空间构型
(2)B元素另外一种氢化物可做火箭的燃料,其电子式为:__________________,中心原子杂化方式为_______________
(3)A元素氧化物晶体类型为____________________,研究发现其氧化物晶胞中,A的位置与金刚石晶胞中碳原子位置相似,试分析晶胞中占有氧原子个数应为___________个。
(4)A、B、C、D第一电离能由小到大的顺序是____________________(用元素符号表示)
已知H2(g)和CO(g)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol。
则一氧化碳与液态水反应,生成二氧化碳和氢气的热化学方程式为
________________________________________________________;
反应aA+bB  cC在体积为2L的容器中进行反应。在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质的量随时间变化的曲线如下图所示:
cC在体积为2L的容器中进行反应。在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质的量随时间变化的曲线如下图所示:
请回答下列各题:
(1)反应的化学方程式为_____________________________
(2)A的平均反应速率vI(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为________________
(3)由计算可知,第Ⅰ段20分钟时,C的平均速率vI(C)=____________________
用质量分数为98%,密度为1.84g·cm-3的浓硫酸配制l mol/L稀硫酸100mL,其操作有以下各步:
①用量筒量取mL浓硫酸
②洗涤烧杯和玻璃棒2-3次,将洗涤液转入容量瓶中
③将稀释、冷却后的硫酸转入100 mL容量瓶中
④将浓硫酸倒入盛有水的烧杯中稀释、冷却
⑤加水至液面接近刻度线1~2cm处,定容,摇匀
完成下列填空:
(1)第①步操作中应用量筒量取mL浓硫酸;应选择mL量筒(填5、10或50)。
(2)本实验用到的基本仪器已有烧杯、量筒、玻璃棒,还缺少的仪器是。
(3)正确的操作顺序是(用序号填写)。
(4)下列操作会使实际浓度偏高,偏低还是不变,请填写:
1).摇匀后,液面低于刻度线,没有再加水;
2).移液过程中,不小心溅出少量溶液;
3).定容时,如果俯视刻度线,配制的硫酸浓度将
CO、O2、CO2混合气体9mL电火花引爆后,恢复到原来状态时,气体体积减少1mL,通过NaOH溶液后,体积又减少5mL,则混合气体中CO、O2、CO2体积比可能为 _____ 。