有机物A为烃类化合物,质谱图表明其相对分子质量为70,其相关反应如下图所示,其中B、D、E的结构中均含有2个—CH3,它们的核磁共振氢谱中均出现4个峰。
请回答:
(1)D的分子式为 B中所含官能团的名称为 ;
(2)Ⅲ的反应类型为 (填字母序号);
a.还原反应 b.加成反应 c.氧化反应 d.消去反应
(3)写出反应Ⅰ的化学方程式 ;
(4)与A具有相同管能团的同分异构体(不包括A)共有 种;
(5)E有多种同分异构体,其中能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为 。
(6分)某温度(t℃)下的溶液中,[H+]=10-xmol·L-1,[OH-]=10-y mol·L-1,x与y的关系如图所示,请回答下列问题:
(1)此温度下,水的离子积KW为_______,则该温度t________25℃(填“>”“<”或“=”),pH=7的溶液显________(填“酸”“碱”或“中”)性。
(2)若将此温度(t℃)下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(假设混合后溶液体积的微小变化忽略不计)。试通过计算填写以下不同情况时两种溶液的体积比。
①若所得混合液为中性,则a∶b=_____________________________________;
②若所得混合液的pH=2,则a∶b=____________________________________。
某粗铜含铁、银、金和铂等杂质,通过电解精炼铜后,为充分利用电解后的阳极泥和电解液,设计如下工艺流程:
回答下列问题:
(1)电解时,以粗铜作______极,______________为电解液,写出阴极的电极反应式______________。
(2)电解后溶液中含有的主要金属阳离子为________________;溶液A是一种绿色氧化剂,则反应①的离子方程式为___________________________________________。
(3)加入的试剂B最好选用___________(填序号)
| A.Cu | B.CuO | C.NaOH | D.氨水 |
(4)写出反应③的离子方程式______________________________________________________
(5)若反应②析出10.8kg银单质,则至少需要乙醛_________kg。
NH3能被O2氧化生成NO,进而氧化成NO2,用来制造硝酸;将NO2(g)转化为N2O4(l),再制备浓硝酸。
(1)2NO(g)+ O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率的不同压强(P1、P2)下随温度变化的曲线如图。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率的不同压强(P1、P2)下随温度变化的曲线如图。
①P1______(填“>”或“<”)P2
②随温度升高,该反应平衡常数变化的趋势是____________。
(2)已2NO2(g) N2O4(g) △H1<0
N2O4(g) △H1<0
2NO2(g) N2O4(l) △H2<0
N2O4(l) △H2<0
下列能量变化示意图中,正确的是_______(填序号)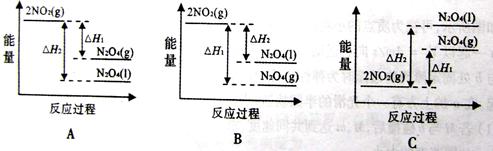
(3)50℃时在容积为1.0L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随着反应的进行,混合气体的颜色变深。达到平衡后,改变反应温度T,10s后又达到平衡,这段时间内,c(N2O4)以0.0020mol/(L·s)的平均速率降低。
2NO2(g),随着反应的进行,混合气体的颜色变深。达到平衡后,改变反应温度T,10s后又达到平衡,这段时间内,c(N2O4)以0.0020mol/(L·s)的平均速率降低。
①50℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(NO2)为_________mol/(L·s)。
②T______(填“>”或“<”) 50℃。
③计算温度T时该反应的平衡常数K(写出计算过程)。
(4)科学家正在开发以氨代替氢气的新型燃料电池有许多优点;制氨工业基础好、技术成熟、成本低、储运方便等。直接供氨式碱性(KOH)燃料电池的总反应为:4NH3+3O2==2N2+6H2O,氨气应通入_______(填“正极”或“负极”)室,正极反应式为_____________________________
选做(15分)【化学选修3:物质结构与性质】
原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原子核外的M层中只有两对成对电子,E+核外各能层电子均已充满。请回答下列问题:
(1)X、Y、Z的第一电离能由小到大的顺序为。(用元素符号表示)
(2)已知YZ2+与XQ2互为等电子体,则l mol YZ2+中含有π键数目为。
(3)Z的气态氢化物沸点比Q的气态氢化物高得多,其原因是。
(4)Y、Z与氢元素可形成化合物HYZ3,是实验室常用试剂。HYZ3分子中Y的杂化方式为,YZ3—的空间构型是。
(5)E原子的价层电子排布式为;E有可变价态,它的基价态的离子与Z的阴离子形成晶体的晶胞如图所示。
①该晶体的化学式为,Z的阴离子的配位数为。
②Z的阴离子的堆积模型为。
A.简单立方B.六方最密C.面心立方
③已知晶胞边长为apm,则晶胞的密度为g• cm—3(阿伏加德罗常数用NA表示)。
选做(15分)【化学选修2:化学与技术】
硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:
(1)“浸出”时,原料中的铜均转化为硫酸铜。写出相应的化学方程式:。
(2)试剂b是(填物质名称),其反应的离子方程式:。
(3)调节pH的目的是。滤渣c是。
(4)在农业上,将胆矾、生石灰和水按一定比例混合制成波尔多液,其反应的化学方程式为。
(5)气体a可以被循环利用,用化学方程式表示其被循环利用的原理为:。
(6)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,写出硫酸铜受热分解的化学方程式:。