选做(15分)【化学选修3:物质结构与性质】
原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原子核外的M层中只有两对成对电子,E+核外各能层电子均已充满。请回答下列问题:
(1)X、Y、Z的第一电离能由小到大的顺序为 。(用元素符号表示)
(2)已知YZ2+ 与XQ2互为等电子体,则l mol YZ2+ 中含有π键数目为 。
(3)Z的气态氢化物沸点比Q的气态氢化物高得多,其原因是 。
(4)Y、Z与氢元素可形成化合物HYZ3,是实验室常用试剂。HYZ3分子中Y的杂化方式为 ,YZ3—的空间构型是 。
(5)E原子的价层电子排布式为 ;E有可变价态,它的基价态的离子与Z的阴离子形成晶体的晶胞如图所示。
①该晶体的化学式为 ,Z的阴离子的配位数为 。
②Z的阴离子的堆积模型为 。
A.简单立方 B.六方最密 C.面心立方
③已知晶胞边长为apm,则晶胞的密度为 g• cm—3(阿伏加德罗常数用NA表示)。
(9分)工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2(g) 2SO3(g)△H=-196.6 kJ·mol-1
2SO3(g)△H=-196.6 kJ·mol-1
(1)生产中为提高反应速率和SO2的转化率,下列措施可行的是。
A.向装置中充入O2B.升高温度
C.向装置中充入N2D.向装置中充入过量的SO2
(2)恒温恒压,通入3mol SO2和2mol O2 及固体催化剂,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g)、3.5 mol O2(g)、1mol SO3(g),下列说法正确的是
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于2/9
(3)500 ℃时将10 mol SO2和5.0 mol O2置于体积为1L的恒容密闭容器中,SO2转化为SO3的平衡转化率为0.95。则500℃时的平衡常数K=。
(4)550 ℃,A、B表示不同压强下的平衡转化率(如图),通常工业生产中采用常压的原因是,
并比较不同压强下的平衡常数:K(0.10 MPa)K(1.0 MPa)。
(9分)某校研究性学习小组的同学学习完氮的有关物质的性质之后,对氮元素的氢化物NH3性质的探究。
(1)实验室制取氨气的化学方程式为。
(2)某同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的?(填“能”或“否”),理由是。
(3)该小组的同学设计了如图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性。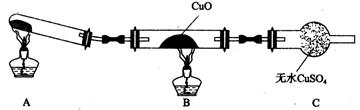
①该装置在设计上有一定缺陷。为保证实验结果的准确性,对该装置的改进措施是
。
②利用改进后的装置进行实验,CuO变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。氨气与CuO反应的化学方程式为。
③有同学认为NH3与CuO反应生成的红色物质中可能含Cu2O。Cu2O在酸性溶液中Cu+歧化生成Cu和Cu2+。请设计一个简单的实验检验该红色物质中是否含有Cu2O
。
(9分)明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下: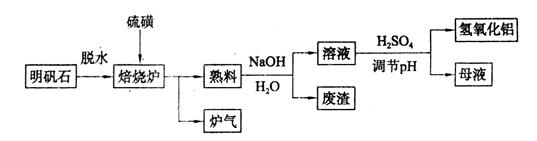
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S 2Al2O3+9SO2,该反应的氧化剂是_______,若生成1 mol Al2O3,则转移的电子数为_______。
2Al2O3+9SO2,该反应的氧化剂是_______,若生成1 mol Al2O3,则转移的电子数为_______。
(2)将标况下1.12L炉气通入100mL 0.5/L NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为_______________ _______。
(3)熟料溶解时反应的离子方程式为___________________________________。
(4)检验废渣中含有Fe2O3所需的试剂是____________。
(5)母液中溶质主要成分的化学式为__________,溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是_________________________。
(10分)A、B、C、D、E、F、G七种元素的原子序数依次递增。已知:
①G的原子序数为29,其余的均为短周期主族元素;
②A是宇宙中含量最多的元素,B原子最外层电子数是次外层电子数的2倍,C原子核外有三个未成对电子;
③D和E原子价电子排布式均为ns2np4;④F的单质是黄绿色气体。
请回答下列问题:
(1)G2+的核外电子排布式是。在[G(NH3)4]2+离子中,G2+与NH3分子形成的是键。
(2)与B、C形成的阴离子(BC—)互为等电子体的微粒有、(分子和离子各写一种)。
(3)B与C形成的化合物中,下列判断正确的是。
a.氢化物稳定性:B>C b.氢化物沸点:B<C
c.最高价氧化物的水化物酸性:B<Cd.非金属性:B>C
(4)B、C、D第一电离能由小到大的顺序为(用元素符号作答),B的一种氢化物相对分子质量为26,分子中的σ键与π键数目比为。
(5)七种元素中,电负性最大的元素与B元素形成化合物电子式为,该物质的晶体属于。
松油醇是一种调香香精,它是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A(下式中的18是为区分两个羟基而人为加上去的)经下列反应制得:
(1)α-松油醇的分子式
(2)α-松油醇所属的有机物类别是
(a)醇(b)酚(c)饱和一元醇
(3)α-松油醇能发生的反应类型是
(a)加成(b)水解(c)氧化
(4)在许多香料中松油醇还有少量以酯的形式出现,写出RCOOH和α-松油醇反应的化学方程式。
(5)写结构简式:β-松油醇,γ-松油醇。