常温下,0.1 mol/L氨水溶液中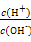 =1×10-8,下列叙述不正确的是( )
=1×10-8,下列叙述不正确的是( )
| A.该溶液中氢离子的浓度:c(H+)=1×10-11 mol/L |
B.0.1 mol/L氨水溶液与0.1 mol/L HCl溶液等体积混合后所得溶液中:c(N )+c(H+)=c(Cl-)+c(OH-) )+c(H+)=c(Cl-)+c(OH-) |
C.0.1 mol/L的氨水溶液与0.05 mol/L H2SO4溶液等体积混合后所得溶液中:c(N )+c(NH3)+c(NH3·H2O)=2c(S )+c(NH3)+c(NH3·H2O)=2c(S ) ) |
D.浓度均为0.1 mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则c(N )>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+) )>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+) |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3NA |
| B.25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
| C.1.8 g D2O中含有的质子数和电子数均为NA |
| D.0.1molNa完全被氧化生成Na2O2时,转移的电子数目为0.1NA |
下列离子方程式书写正确的是
| A.Fe3O4溶于足量稀HNO3:Fe3O4+8H+==Fe2++2Fe3++4H2O |
| B.将过量的SO2通入Ca(ClO)2溶液中: SO2+ClO-+H2O ="=HClO+" HSO3- |
| C.向MgSO4溶液中滴加Ba(OH)2溶液:Ba2+ + SO42-==BaSO4↓ |
| D.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全: |
Ba2+ + 2OH- + NH4+ + H+ + SO4 2- ="=" BaSO4↓+ NH3·H2O + H2O
一定条件下,等物质的量的下列物质分别与足量的浓盐酸反应,产生Cl2的物质的量最多的是
| A.MnO2 | B.KClO3 | C.KMnO4 | D.Ca(ClO)2 |
用pH大小表示溶液的酸碱性相对强弱有许多不足之处。因此,荷兰科学家Henk Van Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG="lg" [c(H+)/c(OH一)] 。常温下,在AG=-10的溶液中能大量共存的离子是:
| A.Ba2+、K+、Cl-、SO32- |
| B.Na+、SiO32-、AlO2—、SO42- |
| C.Na+ 、K+、HCO3-、S2- |
| D.K+ 、NH4+、Fe3+、 I一 |
下列关于元素周期表的说法中正确的是
| A.同一主族元素的原子序数的差不可能为10 |
| B.同周期第ⅡA族与第ⅢA族元素的原子序数差值一定是1 |
| C.催化剂一般在金属与非金属的分界线处寻找 |
| D.过渡元素全部是金属元素 |