(1)某化学兴趣小组的同学进行Cl2、NH3的制备及性质检验等实验的流程和部分装置如下:
①请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2的氧化性强弱为Cl2>Fe3+>I2(实验中不断地小心振荡G装置中的试管)。请写出A中发生反应的离子方程式:______________________________________________,
请写出试剂M为________溶液,证明氧化性为Cl2>Fe3+>I2的实验现象是________________________________________________________________________。
②已知3Cl2+2NH3=6HCl+N2,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b,D中的现象为黄绿色气体消失,产生白烟,反应一段时间后,关闭b打开c,观察到的现象为________________________________________________________________________。
(2)某废水中含有一定量的Na+、SO32—,可能含有CO32—,某研究小组欲测定其中SO32—的浓度,设计如下实验方案: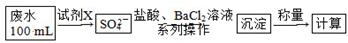
①从下列试剂中选择试剂X为________(填序号);
A.0.1 mol/L KMnO4(H2SO4酸化)溶液B.0.5 mol/L NaOH溶液
C.新制氯水 D.KI溶液
②加入试剂X生成SO42—的离子方程式为_______________________________________
③证明该废水中是否含有CO32—的实验方案为_________________________________________________
某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号),该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)。
(2)判断滴定终点的现象是:锥形瓶中溶液从色变为________色, 且半分钟内不变色。
(3)如图是某次滴定时的滴定管中的液面,其读数为mL。
(4)根据下列数据:请计算待测盐酸溶液的浓度为mol/L。
甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
甲:取纯度相同,质量、大小相等的锌粒于两支试管中,同时加入 0.1 mol·L-1的HA溶液、稀盐酸各10 mL,按图装好,观察现象。
乙:① 用pH计测定浓度均为0.1 mol·L-1的HA溶液和稀盐酸的pH;
② 再取0.1 mol·L-1的HA溶液和稀盐酸各2滴(1滴约为1/20 mL)分别稀释至100 mL,再用pH计测其pH变化。
(1)乙的方案中说明HA是弱电解质的理由是:测得0.1 mol·L-1的HA溶液的
pH1(填“>”、“<”或“=”);甲方案中,说明HA是弱电解质的实验现象是:
(填序号)
A.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
B.加入HA溶液后,试管上方的气球鼓起慢
C.加入稀盐酸后,试管上方的气球鼓起慢
(2) 乙同学设计的实验第步,能证明改变条件弱电解质平衡发生移动。甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:
①使HA的电离程度和c(H+)都减小,c(A-)增大,可在0.1 mol·L-1的HA溶液中,选择加入试剂(选填“A”、“B”、“C”或“D”,下同);
②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol·L-1的HA溶液中,选择加入试剂。
A.NaA固体(可完全溶于水)
B.1 mol·L-1 NaOH溶液
C.1 mol·L-1 H2SO4
D.2 mol·L-1 HA
某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。限选试剂:1.00 mol·L-1 HNO3、2.00 mol·L-1 HNO3,细颗粒大理石、粗颗粒大理石,35 ℃水浴。
(1)他们能完成哪些因素对速率影响的探究?
____________________________________________________________。
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
(3)整个实验中应控制的不变量是硝酸溶液体积和。
(4)该实验小组用如图实验装置进行实验。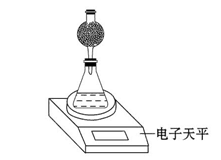
①除电子天平、干燥管、锥形瓶、药匙、胶塞等仪器外,必需的实验仪器还有。
②干燥管中应放置的试剂是。
| A.碱石灰 | B.无水CaCl2 |
| C.P2O5固体 | D.浓硫酸 |
③若撤除干燥管装置,所测速率(填“偏大”、“偏小”或“不变”)。
芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸。反应原理: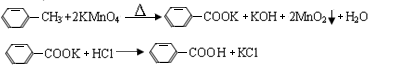
反应试剂、产物的物理常数:
| 名称 |
相对分子质量 |
性状 |
熔点 |
沸点 |
密度 |
溶解度 |
||
| 水 |
乙醇 |
乙醚 |
||||||
| 甲苯 |
92 |
无色液体易燃易挥发 |
-95 |
110.6 |
0.8669 |
不溶 |
∞ |
∞ |
| 苯甲酸 |
122 |
白色片状或针状晶体 |
122.4 |
248 |
1.2659 |
微溶 |
易溶 |
易溶 |
主要实验装置和流程如下:
图1回流搅拌装置图2抽滤装置
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在100℃时,反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。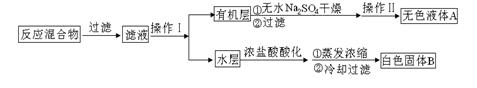
(1)仪器K的名称为。无色液体A的结构简式为。操作Ⅱ为。
如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是。
(3)下列关于仪器的组装或者使用正确的是。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌棒下端不能与三颈烧瓶底、温度计等接触
C.抽滤结束后,为防止倒吸,应先关闭水龙头,再断开真空系统与过滤系统的连接
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入,分液,水层再加入,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220g产品,配成100ml溶液,取其中25.00ml溶液,进行滴定,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为。
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4二主要流程如下:

(1)制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式。
(2)如图所示,过滤操作中的一处错误是。
判断流程中沉淀是否洗净所用的试剂是。高温焙烧时,用于盛放固体的仪器名称是。
(3)在25℃下,向浓度均为0.01 mol・L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成_________________沉淀(填化学式),生成该沉淀的离子方程式_____________________(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]="3×10" -34。)
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
装置B中盛放饱和NaCl溶液,该装置的主要作用是;F中试剂的作用是;用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为。
(5)将Mg、Cu组成的3.92g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体1.792L(标准状况),向反应后的溶液中加入4mol/L的NaOH溶液80mL时金属离子恰好完全沉淀。则形成沉淀的质量为g。