有一种白色粉末,含有下列阴离子和阳离子中的几种。
阴离子:S2-、Cl-、NO3—、SO42—、CO32—、HCO3—、MnO4—。
阳离子:Na+、Mg2+、Al3+、Ba2+、Fe2+、Fe3+、Cu2+、NH4+。
将该白色粉末进行下列实验,观察到的现象如下:
| 实验操作 |
现象 |
| a.取少量粉末,加水、振荡 |
全部溶解、 |
| 溶液无色透明 |
|
| b.向所得溶液中慢慢滴入苛性钠溶液,并加热 |
无明显现象 |
| c.取少量粉末,加盐酸 |
无明显现象 |
| d.取少量粉末,加稀H2SO4和稀HNO3的混合液 |
有白色沉淀生成 |
根据实验推断:
(1)从a实验中,可推断粉末中不可能有______________(填离子符号,下同)。
(2)从b实验中,可推断粉末中不可能有_____________________________________。
(3)从c实验中,可推断粉末中不可能有________________________________。
(4)从d实验中,可推断粉末中不可能有________,一定含有________。
(5)以上各实验仍无法确定是否存在的离子是____________。
将1 mol I2(g) 和2 mol H2置于2L密闭容器中,在一定温度下发生反应:H2(g) + I2(g)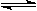 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
(1)达平衡时,I2(g)的物质的量浓度为。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,在乙条件下w(HI)的变化如曲线(Ⅲ) 所示。则甲条件可能是,则乙条件可能是。
(填入下列条件的序号)
①恒容条件下,升高温度;②恒容条件下,降低温度;③恒温条件下,缩小反应容器体积;④恒温条件下,扩大反应容器体积;⑤恒温恒容条 件下,加入适当催化剂。
件下,加入适当催化剂。
(3)若保持温度不变,在另一个相同的2L密闭容器中加入a mol I2(g)、b mol H2(g)和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.6,则a、b、c的关系是。
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)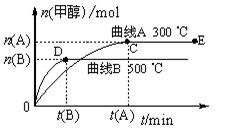
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=,升高温度,K值(填“增大”、“减小”或“不变”)。
(2)在500 ℃,从反应开始到平衡,氢气的平均反应速率v (H2)=。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3 OH)增大
OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:_____________________________(用化学方程式表示)。
(1)请完成下列 各空:
各空:
①pH= a的 CH3COOH溶液稀释100倍后所得
CH3COOH溶液稀释100倍后所得 溶液pHa +2(填“>”或“<”)
溶液pHa +2(填“>”或“<”)
②0.01mol/LCH3COOH溶液的pH2(填“>”或“<”);
(2)观察比较以上两个小题,试猜想证明某酸(HA)是弱电解质的原理有两个:
一是:;
二是: 。
。
(3)请你根据以上原 理提出一些方案,证明HA酸是弱电解质:(只需简明写出方案,不需写出具体步骤,以下项目可不填满也可增加项目)
理提出一些方案,证明HA酸是弱电解质:(只需简明写出方案,不需写出具体步骤,以下项目可不填满也可增加项目)
①
②
丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g) + 5O2(g) ="=" 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1
途径II:C3H8(g) ==C3H6(g)+ H2(g) ΔH=+b kJ·mol-1
2C3H6(g)+ 9O2(g) ="=" 6CO2(g) +6H2O(l)ΔH=-c kJ·mol-1
2H2(g)+O2 (g) ==2H2O(l)ΔH=-d kJ·mol-1 (abcd均为正值 )
)
请回答下列问题:
(1)判断等量的丙烷通过两种途径放出的热量,途径I放出的热量______(填“大于”、“等于”或“小于”)途径II放出的热量
(2)由于C3H8(g) ==C3H6(g)+ H 2(g) 的反应中,反应物具有的总能量______(填“大于”、“等于”或“小于”)生成物具有的总能量,那么在化学反应时。反应物就需要______(填“放出”、或“吸收”)能量才能转化为生成物,因此其反应条件是______________
2(g) 的反应中,反应物具有的总能量______(填“大于”、“等于”或“小于”)生成物具有的总能量,那么在化学反应时。反应物就需要______(填“放出”、或“吸收”)能量才能转化为生成物,因此其反应条件是______________
(3)“西气东输”是西 部开发的重点工程,这里的气体是指天然气,其主要成分是甲烷。使用管道煤气用户改用天然气,应调整灶具进气量阀门,即增大_____(填“空气”或“天然气”)的进入量。据报道,同时燃气价格也将在现有的0.95元/m3的基础上调整到1.31元/m3,请通过计算说明若居民保持生活水平不变,在消耗燃气方面的消费大约是现在的____倍
部开发的重点工程,这里的气体是指天然气,其主要成分是甲烷。使用管道煤气用户改用天然气,应调整灶具进气量阀门,即增大_____(填“空气”或“天然气”)的进入量。据报道,同时燃气价格也将在现有的0.95元/m3的基础上调整到1.31元/m3,请通过计算说明若居民保持生活水平不变,在消耗燃气方面的消费大约是现在的____倍
盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
① Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g)△H= ―24.8 kJ•mol-1
② 3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)△H= ―47.2 kJ•mol-1
③ Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)△H= +640.5 kJ•mol-1
写出CO气体还原FeO固体得到Fe固体 和CO2气体的热化学反应方程式:
和CO2气体的热化学反应方程式:
__________________________________________________。