下表为元素周期表的一部分,请回答有关问题:
| |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
|
|
|
|
① |
⑥ |
② |
|
| 3 |
|
③ |
④ |
⑤ |
|
|
⑦ |
⑧ |
| 4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)画出①的原子结构示意图: , ⑩的元素名称:
(2)③④⑤原子半径由大到小的顺序是 (填元素符号)
(3)表中最活泼的金属是 ,非金属性最强的元素是 ;(填写元素符号)
(4)表中能形成两性氢氧化物的元素是 ,写出该元素的氢氧化物与⑨的最高价氧化物对应水化物反应的离子方程式: 。
(5)用电子式表示③与⑥的化合物的形成过程: 。
(Ⅰ)短周期元素X、Y、Z、W原子序数依次增大,X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中,请回答:
(1)X在元素周期表中的位置是;Y氢化物的电子式。
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈。(填“酸性”、“碱性”或“中性”),用离子方程式表示其原因是。
(3)Y-AgO电池是应用广泛的鱼雷电池,其原理如图所示,该电池的负极反应式。
(4)由Z和W组成的化合物遇水立即水解产生两种酸,写出此反应的化学方程式。
(Ⅱ)A、B、C分别是由H、C、O、N、Na、Cu六种元素中的两种或多种元素组成的化合物。现对A、B、C三种化合物分别做以下实验:
A是一种蓝色固体,B是无色晶体,其式量为68,C是白色固体,分别取A、B、C三种物质少量于三支试管中,加适量水溶解,发现A不溶于水,B、C都能溶于水,并且用pH试纸测定,B与C的水溶液都显碱性。
(1)取A物质少量于一支试管中,后加适量稀盐酸溶解,并用酒精灯微热,发现固体溶解时,伴有气泡产生。将56.8gA隔绝空气加热分解生成40g黑色固体X、无色酸性气体Y(标准状况下,密度为1.96g/L)和水,生成的Y折合成标准状况下的体积为6.72L,则A的化学式为。
(2)取B的水溶液2ml与新制Cu(OH)2混合加热,发现能出现砖红色沉淀,则物质B为。
(3)取16.8gC固体加强热,将生成的气体依次通过经称量过的装CaCl2固体的干燥管和装足量Ba(OH)2水溶液的洗气瓶,后经再次称量发现干燥管增重1.8g,洗气瓶增重4.4g。写出C物质加入水后的溶液显碱性的原因。(用离子方程式和必要文字解释)
(14分) 2013年10月9日,2013年诺贝尔化学奖在瑞典揭晓,犹太裔美国理论化学家马丁·卡普拉斯、美国斯坦福大学生物物理学家迈克尔·莱维特和南加州大学化学家亚利耶·瓦谢尔因给复杂化学体系设计了多尺度模型而分享奖项。三位科学家的研究成果已经应用于废气净化及植物的光合作用的研究中,并可用于优化汽车催化剂、药物和太阳能电池的设计。
汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) △H<0
2CO2(g)+ N2(g) △H<0
(1)同一条件下该反应正反应的平衡常数为K1,逆反应的表达式平衡常数为K2,K1与K2的关系式。
(2)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是(填代号)。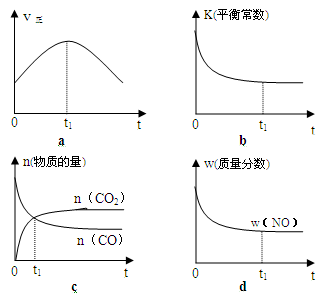
(3)在体积为10L的密闭容器中,加入一定量的CO2和H2,在900℃时发生吸热反应并记录前5min各物质的浓度,第6min改变了条件。各物质的浓度变化如下表;
| 时间/min |
CO2(mol/L) |
H2(mol/L) |
CO(mol/L) |
H2O(mol/L) |
| 0 |
0.2000 |
0.3000 |
0 |
0 |
| 2 |
0.1740 |
0.2740 |
0.0260 |
0.0260 |
| 5 |
0.0727 |
0.1727 |
0.1273 |
0.1273 |
| 6 |
0.0350 |
0.1350 |
0.1650 |
①前2min,用CO表示的该化学反应的速率为;
②第5—6min,平衡移动的可能原因是;
(4)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol
2NO2(g) N2O4(g)△H=-56.9 kJ/mol
N2O4(g)△H=-56.9 kJ/mol
H2O(g) = H2O(l) △H=-44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:。
(5)在一定条件下,可以用NH3处理NOx。已知NO与NH3发生反应生成N2和H2O,现有NO和NH3的混合物1mol,充分反应后得到的还原产物比氧化产物多1.4 g,则原反应混合物中NO的物质的量可能是_____________。
(6)在一定条件下,也可以用H2可以处理CO合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者以物质的量1:1催化反应,其原子利用率达100%,合成的物质可能是。
a.汽油b.甲醇c.甲醛d.乙酸
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl—、OH—、NO3—、CO32—、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是、(填化学式)。
(2)为了确定X,现将(1)中的两种物质记为A和B。当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生二种沉淀,向该沉淀中滴入足量的稀HNO3,沉淀部分溶解,最后留有白色沉淀。则:
①X为(填序号)。
A.SO32—B.CH3COO—C.SO42—D.SiO32—
②化合物A的电子式。
③B的水溶液中所有离子的浓度由大到小的顺序为。
④将0.02 mol的A与0.01 mol的C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量
为g(精确到0.1 g)。
⑤利用上述已经确定的一种物质,可以检验出D、E中的阳离子。请简述实验操作步骤、现象及结论。
(3)将Cu片投入到装有D溶液的试管中,Cu片不溶解;再滴加稀H2SO4,Cu片逐渐溶解,试管口附近有红棕色气体出现,有关反应的离子方程式为。
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
反应II:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
上述反应符合“原子经济”原则的是(填“I”或“Ⅱ”)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1275.6 kJ/mol
②2CO(g)+O2(g)=2CO2(g)ΔH=-566.0 kJ/mol
③H2O(g)=H2O(l) ΔH=-44.0 kJ/mol
则CH3OH(l)+O2(g)=CO(g)+2H2O(l)ΔH=
(3)某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置。
①该电池负极的电极反应为。
②工作一段时间后,测得溶液的pH(填增大、不变、减小)。
③用该电池作电源,组成如下图所示装置(a、b、c、d均为石墨电极),甲容器装250mL0.04mol/LCuSO4溶液,乙容器装300mL饱和NaCl溶液,写出c电极的电极反应,常温下,当300mL乙溶液的pH为13时,断开电源,则在甲醇电池中消耗O2的体积为mL(标准状况),电解后向甲中加入适量下列某一种物质,可以使溶液恢复到原来状态,该物质是(填写编号) 。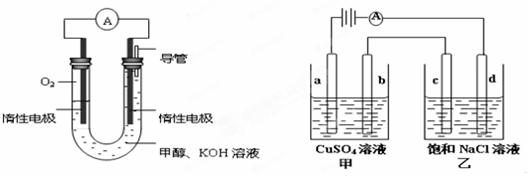
| A.CuO | B.CuCO3 | C.Cu(OH)2 | D.Cu2(OH)2CO3 |
A、B、C、D、E五种短周期元素,A与D同周期,A的单质既可与盐酸反应,又可与NaOH溶液反应,B的单质在放电条件下能与氧气反应,C元素的离子不含电子,D元素原子的最外层电子数是其次外层电子数的3/4,E元素原子的最外层电子数是其次外层电子数的3倍。
(1)A的原子结构示意图为 。
(2)0.1 mol/L A的硫酸盐溶液与0.1 mol/L NaOH溶液等体积混合,反应的离子方程式为。
(3)以A的单质和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池总反应的化学方程式是。
(4)化合物甲由元素A、B组成,具有良好电绝缘性。化合物甲能与水缓慢反应生成含B的化合物乙,乙分子中含有10个电子。写出该反应的化学方程式:。工业用A的单质和化合物乙在高于1700K反应制备甲。已知该反应可以认为是置换反应,该反应的化学方程式是。
(5)D和E两种元素相比较,非金属性较强的是(填元素名称),可以验证该结论的是(填写编号);
a.比较这两种元素的常见单质的沸点
b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性
(6)C、D、E间可形成丙、丁两种分子,它们均含有18个电子,则丙与丁反应生成D单质的化学方 程式为;