硫一碘循环分解水制氢的主要反应如下:
(1)上述循环反应的总反应可以表示为____________________;反应过程中起催化作用的物质是__________(选填编号)。
a. b.
b. c.
c. d.HI
d.HI
(2)一定温度下,向2L密闭容器中加入1molHI(g),发生反应II, 的物质的量随时间的变化如图所示。0~2min内的平均反应速率
的物质的量随时间的变化如图所示。0~2min内的平均反应速率 _________。
_________。
(3)对反应II,在相同温度和体积下,若开始加入的HI(g)的物质的量是原来的2倍,则以下_________也是原来的2倍(选填编号),
a.平衡常数 b.HI的平衡浓度
c.达到平衡时间 d.平衡时 的体积分数
的体积分数
(4)实验室用锌和稀硫酸反应制取 ,反应时溶液中水的电离平衡______移动(选填“向左”、“向右”或“不”);若加入少量下列试剂中的_____(选填编号),产生
,反应时溶液中水的电离平衡______移动(选填“向左”、“向右”或“不”);若加入少量下列试剂中的_____(选填编号),产生 的速率将增大。
的速率将增大。
a. b.
b. c.
c. d.
d.
(12分)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下: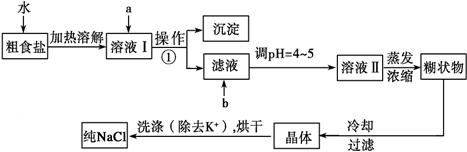
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳、稀盐酸。
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO ,选出a所代表的试剂,按滴加顺序依次为____________________ (只填化学式)。
,选出a所代表的试剂,按滴加顺序依次为____________________ (只填化学式)。
(2)如何检验 SO 是否沉淀完全。
是否沉淀完全。
(3)调节pH 的目的,试剂b是(填名称)。
(4)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_________,使用该试剂的目的是。
(10分)某溶液中可能含有下列6种离子中的某几种:Cl-、SO 、NH4+、CO
、NH4+、CO 、K+、Na+。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。
、K+、Na+。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。
(1)溶液一定存在的离子有,可能存在的离子有。
(2)原溶液中c(CO )为,c(NH4+)c(SO
)为,c(NH4+)c(SO ) (填“>、<或=”)。
) (填“>、<或=”)。
(3)如果上述6种离子都存在,则c(Cl-)c(SO ) (填“>、<或=”)。
) (填“>、<或=”)。
(14分)(1)O2、SO2、SO3三者质量之比为1∶2∶5,则它们的氧原子数之比为
(2)某金属氯化物MCl2 40.5 g中含有0.6 mol Cl-,则MCl2的摩尔质量为,金属M的相对原子质量为。
(3)在无土栽培中,配制1 L内含5 mol NH4Cl、1.6 mol KCl、2.4 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需这三种固体的物质的量分别为、、。
(4)相同浓度的NaCl、MgCl2、AlCl3溶液,分别与AgNO3溶液反应,当生成的AgCl沉淀的质量之比为3∶2∶1时,三种溶液的体积比为________。
降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实
验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生
反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。
①图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反
应是(填“吸热”或“放热”)反应。
②500℃达平衡时,CH3OH的体积分数为。
(2)下图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g) 和2.4molH2O(g),两容器分别发生上述(1)中反应的逆反应。
已知:起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为L(连通管中气体体积忽略不计,且不考虑温度的影响)。
工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3)同时生成二氧化碳,其三步反应如下:
① 2H2 (g)+CO(g)  CH3OH (g) ΔH= -90.8 kJ·mol-1
CH3OH (g) ΔH= -90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+H2O(g)  CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
(1)总合成反应的热化学方程式为。
(2)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是_____(填字母代号)。
A 高温高压 B 加入催化剂 C 减少CO2的浓度
D.增加CO的浓度 E.分离出二甲醚
(3)反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度(mol/L)随反应时间(min)的变化情况如下表:
CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验 序号 |
温度 浓度 时间 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
①实验1,反应在10至20分钟时间内用CH3OH(g)表示的平均速率为。
②实验2,CH3OH(g)的初始浓度c2=mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是。
③设实验3的反应速率为v3,实验1的反应速率为v1,则v3v1(填>、=、<),且c3=mol/L。