)2013年全国各地连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害,因此研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
I.脱硫技术能有效控制SO2对空气的污染。
(1)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、CI-、SO42-、Br-、HCO3-等离子。含SO2的烟气可利用海水脱硫,其工艺流程如下图所示: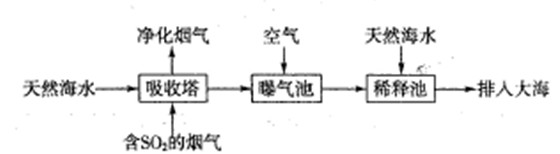
①向曝气池中通入空气的目的是
②通入空气后曝气池中海水与天然海水相比,浓度没有明显变化的离子是 。
a.Cl- B.SO42- C.HCO3-
(2)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
①图中b极要连接电的(填“正”或“负”) 极,C口流出的物质是 。
②SO32-放电的电极反应式为
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因 。
II.我国的能消费结构以燃煤为主,将煤气化可减少环境污染,但煤气化过程中能产生有害气体H2S,用足量的Na2CO3溶液可吸收,该反应的离子方程式为 。
(已知:H2S Kal=9.1×10-8;Ka2=1.1 ×10-12;H2CO3 Kal=4.30×10-7;Ka2=5.61 ×10-11)
过硫酸钾(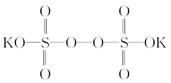 )具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:
)具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下: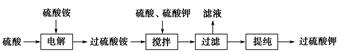
(1)硫酸铵和硫酸配制成电解液,以铂作电极进行电解,生成过硫酸铵溶液。写出电解时发生反应的离子方程式_____________________________________
___________________________________。
(2)已知相关物质的溶解度曲线如右图所示。在实验室中提纯过硫酸钾粗产品的实验具体操作依次为:将过硫酸钾粗产品溶于适量水中,________________,干燥。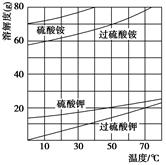
(3)样品中过硫酸钾的含量可用碘量法进行测定。实验步骤如下:
步骤1:称取过硫酸钾样品0.300 0 g于碘量瓶中,加入30 mL水溶解。
步骤2:向溶液中加入4.00 0 g KI固体(略过量),摇匀,在暗处放置30 min。
步骤3:在碘量瓶中加入适量醋酸溶液酸化,以淀粉溶液作指示剂,用0.100 0 mol·L-1Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3标准溶液21.00 mL。
(已知反应:I2+2S2O32-=2I-+S4O62-)
①若步骤2中未将碘量瓶“在暗处放置30 min”,立即进行步骤3,则测定的结果可能________(选填“偏大”、“偏小”、“无影响”);上述步骤3中滴定终点的现象是____________________________________________。
②根据上述步骤可计算出该样品中过硫酸钾的质量分数为_______________。
③为确保实验结果的准确性,你认为还需要____________________________。
(4)将0.40 mol过硫酸钾与0.20 mol硫酸配制成1 L溶液,在80 ℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如图所示(H+浓度未画出)。图中物质X的化学式为________________________。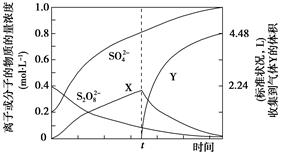
氟化铜是一种锂/氟化铜电池正极活性材料,可通过下列方法制备:在铂皿中将氧化铜用过量的40%氢氟酸溶解,先制成CuF2·5HF·5H2O,再将生成物放入镍管内的铂舟中,在干燥的氟化氢气流中以400%进行加热脱水,最后通入氮气。
(1)制备过程中用铂皿而不用玻璃器皿的原因是______________________________________(用化学方程式表示)。
(2) 锂/氟化铜电池放电时总反应为置换反应,其化学方程式为____________________________________________________。
(3)准备称取上述制备的样品(仅含CuF2和CuO) 2.120 g,在通风橱中加入稀硫酸至完全溶解,然后加入足量的氢氧化钠溶液,得沉淀,将沉淀充分灼烧,得1.680 g黑色固体,计算样品中CuF2和CuO的物质的量之比。
吡洛芬是一种用于治疗风湿病的药物。它的合成路线如下: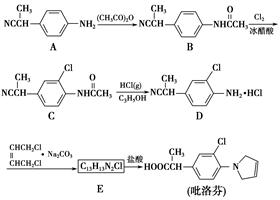

回答下列问题:
(1)B→C的反应类型为_____________________________。
(2)A→B反应的化学方程式为______________________________________
__________________________________。
从整个合成路线看,步骤A→B的目的是_______________________________。
(3)E的结构简式为____________________________。
(4)A在一定条件下可生成
F(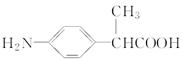 )。写出同时满足下列条件的F的两种同分异构体的结构简式_____________________________。
)。写出同时满足下列条件的F的两种同分异构体的结构简式_____________________________。
①属于芳香族化合物;②是一种α氨基酸;③分子中有6种不同化学环境的氢。
(5)非那西汀是一种解热药,其结构简式为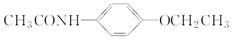 ,写出以苯酚钠、CH3CH2OH和(CH3CO)2O为原料制备非那西汀的合成路线流程图(无机试剂任用) 。合成路线流程图示例如下:
,写出以苯酚钠、CH3CH2OH和(CH3CO)2O为原料制备非那西汀的合成路线流程图(无机试剂任用) 。合成路线流程图示例如下: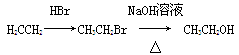
以重晶石(主要成分为BaSO4)为主要原料制备立德粉(ZnS和BaSO4的混合物)的工艺流程如下:
(1)焙烧时,焦炭需过量,其目的是:①____________________________;②____________________________。
(2)焙烧过程中发生的反应之一是4CO(g)+BaSO4(s) BaS(s)+4CO2(g),该反应的平衡常数的表达式为__________________________________________________。
BaS(s)+4CO2(g),该反应的平衡常数的表达式为__________________________________________________。
反应器中发生反应的化学方程式为____________________________________。
(4)用工业级氧化锌(含少量FeO和Fe2O3杂质)和硫酸制取硫酸锌溶液时,需先后加入H2O2溶液和碳酸锌精制,加入H2O2溶液时发生反应的离子方程式为
________________________________,加入碳酸锌的目的是将溶液中的Fe3+转化为红褐色沉淀,写出该反应的化学方程式:__________________________________________。
下列是以芳香烃A为原料制备扁桃酸( )的流程图。请回答下列问题:
)的流程图。请回答下列问题: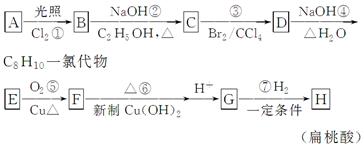
(1)A的结构简式为________,D中官能团的名称是________。
(2)C中所有碳原子________(填“能”或“不能”)共面,产物B的结构简式可能有两种,分别为________。
(3)写出下列反应的化学方程式:
E→F:________________________________________________________;
G→H:_______________________________________________________。
(4)上述转换中属于加成反应的是________(填序号)。
(5)设计实验证明物质B含有氯元素________________________________