(14分)铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程:
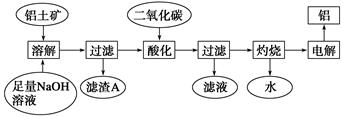
已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
②除硅的方法:溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为2Na2SiO3+2NaAlO2+2H2O===Na2Al2Si2O8↓+4NaOH。
回答下列问题:
(1)Al元素在元素周期表中的位置为 ;电解制取Al的化学反应中,反应物总能量 生成物总能量(填“大于”、“等于”或“小于”);二氧化碳的结构式为 。
(2)写出向Al2O3与氢氧化钠溶液发生反应的离子方程式 _____。
(3)滤渣A的主要成分为__________________________。
(4)在工艺流程第三步中,通入过量二氧化碳的化学反应方程式是_______________________。
(5)实验时取铝土矿ag,经过上述工艺流程最后得到bgAl,则铝土矿中的Al2O3质量分数为 。
| A.=102b/54a | B.>102b/54a | C.<102b/54a | D.均有可能 |
某反应的平衡常数表达式为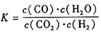 ,恒容时,温度升高.H2浓度减小。分析下列问题:
,恒容时,温度升高.H2浓度减小。分析下列问题:
(1)该反应的化学方程式为:
(2)温度升高,该反应的K值______________(填“增大”“减小”或“不变”),化学平衡移动后达到新的平衡,CO2和CO体积比_______________(填“增大”“减小”或“不变”)。
(3)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生反应,CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min),850℃的化学平衡常数的值K=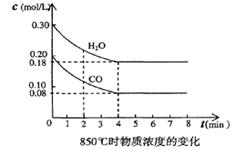
(4)850℃时,在相同容器中发生反应CO2+ H2 CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、二氧化碳0.08 mol/L、氢气 0.08 mol/L,此时v(正)v(逆)(“大于”“ 小于”“等于”)
CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、二氧化碳0.08 mol/L、氢气 0.08 mol/L,此时v(正)v(逆)(“大于”“ 小于”“等于”)
把煤作为燃料可通过下列两种途径:
|
|
|
|
 2CO(g)+O2(g) ="==" 2CO2(g)
2CO(g)+O2(g) ="==" 2CO2(g)
(1)相同温度时,向两个开始体积相同的容器中分别充入2molSO2和1molO2,甲容器保持恒压,乙容器保持恒容,达到平衡时:(填“大于“小于”“等于”)
反应速率v甲_____ v乙,SO2的转化率ω甲_____ω乙,所需时间t甲____t乙。 (2)在容积相同的两个密闭容器A和B中,保持温度为423K,若同时分别向A和B中加入amol和2amol的HI气体,待反应:2HI(g) H2(g)+I2(g)均达到平衡时:(填“大于“小于”“等于”)
(2)在容积相同的两个密闭容器A和B中,保持温度为423K,若同时分别向A和B中加入amol和2amol的HI气体,待反应:2HI(g) H2(g)+I2(g)均达到平衡时:(填“大于“小于”“等于”)
I2的浓度c(I2)A____c(I2)B, ,I2蒸气在混合气体中的体积分数A容器__B容器
(1)把镁条投入盛有盐酸的敞口容器中,产生氢气速率变化如图所示。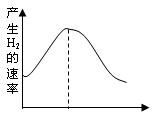
在反应过程中导致速率变化的因素有
①H+的浓度②镁条的表面积③溶液的温度④Cl—的浓度
(2)影响速率的有关因素有:物质本身的性质、浓度、温度、催化剂等方面,依据影响速率的有关因素分析下列问题:
①Mg和Fe均可以与O2反应, Mg在空气中可以点燃, Fe在空气中不能点燃,是由于的影响;
②Fe在空气中加热不能燃烧,但在纯氧中可以,是由于的影响;
现从固体KOH出发配制0.1mol/L 的KOH溶液 500mL,回答下列问题:
(1)配制过程中需要用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、
(2)如果在定容时仰视操作,则所配得溶液的浓度0.1mol/L(填> , =" ," <)
(3)若所用的固体KOH中混有NaOH,则所配得溶液的OH-浓度0.1mol/L(填> , =" ," <)
(4)若用250mL的H2SO4溶液恰好能将此500mL 0.1mol/L 的KOH溶液中和,则该硫酸的物质的量浓度为mol/L