工业上将制取重铬酸钾(K2Cr2O7)和铬酸酐(CrO3)的剩余废渣称为铬渣,其成分为SiO2、Al2O3、MgO、Fe2O3、CrO3、K2Cr2O7等。
已知:
①重铬酸钾和铬酸酐都易溶于水,这是造成铬污染的主要原因,它们都是强氧化剂,铬酸酐溶于水呈酸性;
②+6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小。
③下表为一些金属氢氧化物沉淀的pH参照数据。
| 物质 |
开始沉淀 |
完全沉淀 |
| Fe(OH)3 |
2.7 |
3.7 |
| Al(OH)3 |
3.7 |
4.7 |
| Cr(OH)3 |
4.7 |
a |
| Fe(OH)2 |
7.6 |
9.6 |
| Mg(OH)2 |
9.6 |
11.1 |
回答下列处理铬渣、消除铬污染的有关问题:
(1)将铬渣用稀硫酸浸取、过滤,在浸出液中加入适量的绿矾(FeSO4·7H2O),加入绿矾的目的是_____________________________________________
(2)再向浸出液中缓慢加入烧碱,至pH刚好达到4.7,过滤,所得沉淀的化学式是____________________________________________________________;
常温下,Cr(OH)3的溶度积Ksp=10-32,要使Cr3+完全沉淀[c(Cr3+)降至10-5 mol·L-1视为沉淀完全],溶液的pH应调于a=________。
(3)向(2)中得到的滤液中加入硫酸,调节至呈强酸性,所得的溶液是含____________________溶质的溶液。
根据要求填写:
(1)金属钠在空气中燃烧,火焰呈色,化学方程式:;
(2)将过氧化钠固体放入试管中加入少量水,再加入几滴酚酞试液,溶液变红色但很快褪色,原因是:,过氧化钠固体与水反应的化学方程式: ;
;
(3)苏打和小苏打分别和同浓度的盐酸反应,反应较快且剧烈的是(填化学式),小苏打与盐酸反应的离子方程式为: ;
;
(4)金属钠和金属钾分别和水反应试验中,其中反应较剧烈的反应的化学方程式:;
 A质子数、B中子数、C质子数和中子数、D最外层电子数、E电子层数,请用单个序号填写下列各空白。
A质子数、B中子数、C质子数和中子数、D最外层电子数、E电子层数,请用单个序号填写下列各空白。
元素的种类由(1)决定;元素的化学性质主要由(2)决定;是否是同位素由(3)决定。
写出 下列物质的电离方程式或者化学
下列物质的电离方程式或者化学 式:
式:
(1)硫酸__________________(电离方程式)
(2)纯碱___________________(化学式)
(3)醋酸______________________(化学式)
(4)大理石的主要成分____________(化学式)
 现有20g由2H和16O组成的水分子,其中含质子数为__________,中子数为_________,电子数为__________。
现有20g由2H和16O组成的水分子,其中含质子数为__________,中子数为_________,电子数为__________。
(8分)水煤气的制法是在高温下炽热的炭跟水发生如下的反应:C+H2O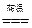 CO+H2。其中被还原的元素是
CO+H2。其中被还原的元素是 ,被氧化的元素是,氧化剂是
,被氧化的元素是,氧化剂是 ,还原剂是
,还原剂是