常温下,将a mol/L的MOH(可溶性弱碱)与b mol/L盐酸等体积混合,已知相同条件下MOH的电离程度大于M+的水解程度,则下列有关推论不正确的是( )
| A.若混合后溶液pH=7,则c(M+)=c(Cl-) |
| B.若b=2a,则c(Cl-)>c(M+)>c(H+)>c(OH-) |
| C.若a=2b,则c(M+)>c(Cl-)>c(OH-)>c(H+) |
| D.若混合后溶液满足c(H+)=c(OH-)+c(MOH),则可推出a=b |
如图曲线a和b是盐酸与氢氧化钠相互滴定的滴定曲线,下列叙述正确的是
| A.盐酸的物质的量浓度为1 mol·L-1 |
| B.P点时恰好完全反应,溶液呈中性 |
| C.曲线a是盐酸滴定氢氧化钠的滴定曲线 |
| D.酚酞不能用作本实验的指示剂 |
下列操作,妥当的是
| A.用托盘天平称量氢氧化钠固体时,需在左、右托盘上各放一块质量相等的滤纸 |
| B.用25 mL滴定管量取25 mL的氢氧化钠溶液时,需将调好零点的滴定管内所有液体放出 |
| C.用25 mL滴定管量取10 mL氢氧化钠溶液时,下端玻璃导管尖嘴悬挂的液滴不需处理 |
| D.用量筒量取一定量体积的液体配制一定物质的量浓度的溶液时,不需把蒸馏水洗涤量筒后的洗涤液移入容量瓶 |
关于下列各装置图的叙述中,正确的是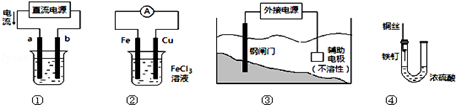
| A.用装置①精炼铜,则b极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| C.装置③中钢闸门应与外接电源的正极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
25℃时,Kw=1.0×10﹣14;100℃时,Kw=5.5×10﹣13.下列说法正确的是
| A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的pH=7 |
| B.25℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl等体积混合,所得溶液的pH=7 |
| C.25℃时,0.2 mol/L NaOH溶液与0.2 mol/L CH3COOH恰好中和,所得溶液的pH=7 |
| D.25℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液的pH>7 |
在25 ℃时,向V mL pH=m的HNO3中滴加pH=n的KOH溶液10V mL时,溶液中NO的物质的量恰好等于加入的K+的物质的量,则m+n的值为
| A.13 | B.14 | C.15 | D.不能确定 |