用图所示装置进行下列实验,实验结果与预测的现象不一致的是
| |
①中的物质 |
②中的物质 |
预测①的现象 |
| A |
酚酞溶液 |
浓氨水 |
溶液变红色 |
| B |
酚酞溶液 |
浓硝酸 |
无明显变化 |
| C |
饱和CuSO4溶液 |
浓硫酸 |
无明显变化 |
| D |
FeCl3溶液 |
KSCN溶液 |
无明显变化 |
化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g)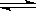 N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g)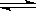 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g)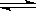 2CO(g)+O2(g) K3=
2CO(g)+O2(g) K3= 4×10-92
4×10-92
以下说法正确的是
| A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2) |
| B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80 |
C.常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>C O2 O2 |
| D.以上说法都不正确 |
某温度下,向容积为2 L的密闭反应器中充入0.10 mol SO3,当反应器中的气体压强不再变化时测得SO3的转化率为20%,则该温度下 反应2SO2(g)+O2(g)
反应2SO2(g)+O2(g) 2SO3(g)的平衡常数为
2SO3(g)的平衡常数为
| A.3.2×103 | B.1.6×103 | C.8.0×102 | D.4.0×102 |
一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是
| A.c1∶c2=3∶1 |
| B.平衡时,Y和Z的生成速率之比为2∶3 |
| C.X、Y的转化率相等 |
D.c1的取值范围为0.04 mol /L<c1<0.1 /L<c1<0.1 4 mol/L 4 mol/L |
在一定温度下的定容密闭容器中,当物质的下列物 理量不再变化时,不能说明反应A(s)+2B(g)
理量不再变化时,不能说明反应A(s)+2B(g)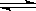 C(g)+D(g)已达平衡状态的是
C(g)+D(g)已达平衡状态的是
| A.混合气体的压强 |
| B.混合气体的密度 |
| C.B的物质的量浓度 |
| D.气体的平均相对分子质量 |
对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述中正确的是( )
4NO(g)+6H2O(g),下列叙述中正确的是( )
| A.达到化学平衡时4v正(O2)=5v逆(NO) |
B.若单位时间内生成x mol NO的同时 ,消耗x mol NH3,则反应达到平衡状态 ,消耗x mol NH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大 |
| D.化学反应速率的关系是2v正(NH3)=3v正(H2O) |