亚硝酸钠广泛用于印染、漂白等行业,在建筑行业用作防冻剂,在食品工业作防腐剂和增色剂,它是一种潜在致癌物质,过量或长期食用对人产生危害,由于亚硝酸钠有咸味,外观与NaCl相似,曾多次发生被当食盐误食的事件。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置,利用一氧化氮与过氧化钠反应制备亚硝酸钠。(夹持装置和A中加热装置已略,气密性已检验),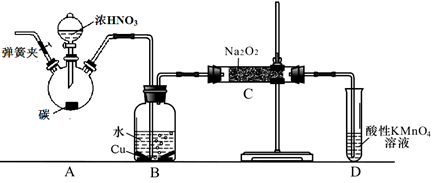
查阅资料:①HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O;
②NO2-能被很多常见的强氧化剂氧化,如在酸性溶液中可将MnO4-还原为Mn2+且无气体生成。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
④HNO2在酸性溶液也是一种氧化剂,如能把I-氧化成I2。
⑤AgNO2是一种难溶于水易溶于酸的白色化合物。
(1)写出C中制备亚硝酸钠反应的化学方程式(反应物的物质的量之比为2:1) 。
(2)D装置的作用是 。
(3)经检验C产物中亚硝酸钠含量较少。甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠。为排除干扰甲同学在B、C装置间增加装置E,E中盛放的试剂应是________(写名称)。
(4)人体正常的血红蛋白中含Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是 。
A.亚硝酸盐是还原剂 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐被还原
(5)能用来鉴别NaNO2和NaCl的方法是
A .测溶液pH法
B.加酸法
C.AgNO3和HNO3两种试剂法
D.加KI淀粉(酸性)法
E.以上四种方法都可
(6)某同学把溴水加到NaNO2溶液观察到溴水褪色,请写出此反应的离子方程式 。
短周期元素的单质X、Y、Z在通常状况下均为气态,并有下图转化关系(反应条件略去),已知:
a.常见双原子单质分子中,X分子含共价键最多。
b.甲分子中含10个电子,乙分子含有18个电子。
(1)X的电子式是_______________________。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。
①在图中方框内绘出收集甲的仪器装置简图。
②试管中的试剂是____________________。(填写化学式)
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)_________________________。
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是__________。
(10分)实验室用乙醇与浓硫酸共热制取乙烯,常因温度过高生成少量SO2,有人设计了如下图所示实验,以验证上述混合气体中是否含有乙烯和SO2。
⑴.装置中X仪器的名称是:;碎瓷片的作用是:。
⑵.写出生成乙烯的反应方程式:。
⑶.A、B、C、D装置中可盛放的试剂是(从下列所给试剂中选出,填序号):
①品红溶液,②NaOH溶液,③溴水,④KMnO4酸性溶液。
A.;B.;C.;D.。
⑷.能说明SO2气体存在的现象是。
⑸.确证含有乙烯的现象是。
用已知浓度的盐酸滴定未知浓度的氢氧化钾溶液,滴定过程中进行如下操作,分别指出各项的操作对测定结果的影响(可用“偏高”、“偏低”、“无影响”).
(1)滴定前,滴定管尖咀处有气泡,滴定后气泡消失.
(2)滴定管经蒸馏水洗涤后,即装入标准溶液进行滴定
(3)滴定前,锥形瓶用蒸馏水洗涤后,未用待测的氢氧化钾溶液润洗就做滴定.
(4)用滴定管量取待测液后,又用蒸馏水洗涤滴定管,并将洗涤液一起注入锥形瓶中
实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2+4HCl(浓)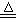 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O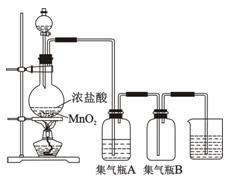
试回答下列问题:
(1)该反应是氧化还原反应吗?①(填“是”或“不是”),如果是氧化还原反应,指出②氧化剂是,③还原剂是,④写出该反应的离子 方程式。
方程式。
(2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯
化氢在饱和食盐水中的溶解度则很大),其作用是。
(3)氯气溶于水显酸性,且氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中
毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用溶液来吸收有毒的氯气。
(4)一次实验中,加入浓盐酸200mL,其密度为1.19g·cm-3、HCl的质量分数为36.5%,
当MnO2刚好完全反应时,产生了5.6L(标准状况)的氯气。
试计算该浓盐酸的物质的量浓度和被氧化的HCl的物质的量。(请写出计算过程)
下图为实验室制取蒸馏水的装置示意图,根据图示回答下 列问题。
列问题。
(1)图中的两处明显的错误是:
①;
②。
(2)A仪器的名称是,B仪器的名称是。
(3)实验时A中除加入少量自来水
 外,为防止液体暴沸还需加入少量。
外,为防止液体暴沸还需加入少量。