钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。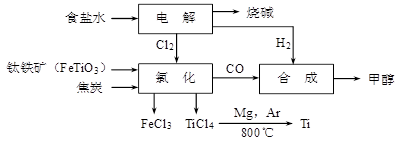
请回答下列问题:
(1)Fe的原子序数为26,其最外层电子数为2,请写出铁原子结构示意图_______。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)氯碱厂获得Cl2的离子方程式为
| |
TiCl4 |
Mg |
MgCl2 |
Ti |
| 熔点/℃ |
-25.0 |
648.8 |
714 |
1667 |
| 沸点/℃ |
136.4 |
1090 |
1412 |
3287 |
(4)由TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
(5)为了减少产业链生产时产生的工业三废对环境的威胁,当NaCl与FeTiO3的物质的量之比为 时,理论上Cl2的利用率最大。
已知Na2SO4和NaCl混合溶液中,Cl-的物质的量浓度是Na+的物质的量浓度的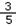 倍,下列叙述中正确的是( )
倍,下列叙述中正确的是( )
| A.Na2SO4和NaCl的物质的量之比为1 :3 |
| B.溶液中一定有1molNa2SO4和3molNaCl |
C.所带电荷数SO42-是Na+的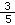 倍 倍 |
D. SO42-与Cl-的物质的量之和等于Na+的物质的量 SO42-与Cl-的物质的量之和等于Na+的物质的量 |
锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
① 2Sb2S3+3O2+6Fe=Sb 4O6+6FeS ②Sb4O6+6C=4Sb+6CO。关于反应①、②的说法正确的是()
4O6+6FeS ②Sb4O6+6C=4Sb+6CO。关于反应①、②的说法正确的是()
| A.反应①②中的氧化剂分别是Sb2S3、Sb4O6 |
| B.反应②说明高温下Sb的还原性比C强 |
| C.反应①中每生成3 mol FeS时,共转移6 mol电子 |
| D.每生成4 mol Sb时,反应①与反应②中还原剂的物质的量之比为4︰3 |
能正确表示下列化学反应的离子方程式的是( )
| A.碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2↑ |
| B.氢氧化钡溶液与硫酸反应Ba2++OH-+H++SO42-=BaSO4↓+ H2O |
| C.澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O |
| D.铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag |
5L 1mol/L FeCl3溶液与0.2L 1mol/LKCl溶液中的C(Cl-)之比是()
| A.5 :2 | B.15 :2 |
| C.1 :3 | D.3 :1 |
常温下,在溶液中可以发生反应:X+2Y3+=2Y2++X2+,对下列叙述的判断正确的是( )
① X被氧化②X是氧化剂
X被氧化②X是氧化剂 ③X具有还原性④Y2+是氧化产物⑤Y2+具有还原性
③X具有还原性④Y2+是氧化产物⑤Y2+具有还原性
⑥Y3+的氧化性比X2+的氧化性强
| A.①③④ | B.①③⑤⑥ | C.②④⑥ | D.②⑤ |