下列图示与对应的叙述相符的是: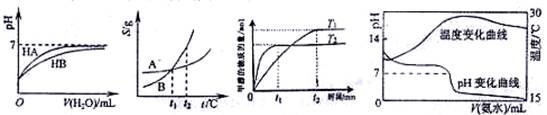
图1 图2 图3 图4
A.图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液PH随加水量的变化,则NaA溶液的PH小于同浓度的NaB溶液的PH。
B.图2表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数 B﹥A。
C.图3表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是吸热反应。
D.图4表示将1.000 mol/L氨水滴入20.00mL1.000 mol/L盐酸中,溶液PH和温度随加入氨水体积变化曲线
NH3和Cl2可快速反应:2NH3+3Cl2 →N2+6HCl 。有100LNH3和Cl2混合气体,充分反应后的混合气体中N2占混合气体的1/7,则N2的物质的量为(标准状况下数据)
| A.0.263 mol | B.0.483 mol | C.0.663 mol | D.0.893 mol |
下列离子方程式正确的是
A.用惰性电极电解饱和食盐水:2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
B.苯酚与碳酸钠溶液: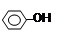 + CO32—→ + CO32—→ + H2CO3 + H2CO3 |
| C.等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++ 3SO42-+ 3Ba2++6OH-→3BaSO4↓+ 2Fe(OH)3↓ |
| D.在强碱性溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3→2FeO42-+3Cl-+ H2O+4H+ |
在恒容密闭容器进行的可逆反应:MgSO4(s) + CO(g)  MgO(s) + CO2(g) + SO2(g)-Q,下列分析合理的是
MgO(s) + CO2(g) + SO2(g)-Q,下列分析合理的是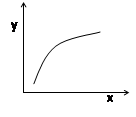
| A.若平衡常数K值变大,平衡移动时v逆先减小后增大 |
| B.容器中固体物质的质量不再改变,则反应到达平衡状态 |
| C.若x表示温度,y可表示平衡时混合气体的密度 |
| D.若x表示CO物质的量,y可表示平衡时CO2与CO物质的量之比 |
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列判断合理的是
| A.元素W分别与X、Y、Z形成的化合物都是离子化合物 |
| B.四种元素简单离子的半径:X < Y < Z < W |
| C.Z与其他三种元素形成的常见化合物中有离子晶体、原子晶体和分子晶体 |
| D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
下列事实不能用平衡移动原理解释的是
 |
     |
 |
 |
| A |
B |
C |
D |