A、B、C、D四种可溶的化合物(所含离子各不相同),分别由阳离子Na+、Mg2+、Al3+、Ba2+和阴离子OH-、Cl-、SO42-、CO32-两两组合而成。为了确定这四种化合物的成分,某同学进行了如下实验操作:
①将四种化合物各取适量配成溶液,分别装入四支试管。
②取A溶液分别滴入另外三种溶液中,记录实验现象如下:
B溶液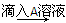 白色沉淀
白色沉淀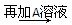 沉淀不溶解
沉淀不溶解
C溶液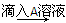 白色沉淀
白色沉淀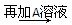 沉淀不溶解
沉淀不溶解
D溶液 白色沉淀
白色沉淀 沉淀部分溶解
沉淀部分溶解
③向B溶液中滴入D溶液,无明显实验现象。
请回答下列问题:
(1)写出它们的化学式:A________;B________;C________;D________;
(2)上述②的第三次实验,再加入A,沉淀部分溶解的离子方程式为_________________________________________________________________。
(3)③中若向C溶液中滴入D溶液,可能出现的实验现象是_________________________________________________________________。
用离子方程式表示其原因:_________________________________________。
下图是A~Z在一定条件下的转化关系(部分反应物或产物未列出)。其中,A是生活中广泛使用的金属单质,常温下C是一种常见液体化合物,E、F、X均为气体。物质Y和Na2AO4均有强氧化性,可用于杀菌消毒,Z是一种红褐色固体。
请回答下列问题:
(1)Y的电子式为;
(2)在①~⑧中属于氧化还原反应,但又不是化合反应的是(填序号)
(3)反应⑤的离子方程式是
(4)若在反应④中转移电子数为2NA,则消耗的F在标准状况下的体积是L。
(5)反应⑧的化学方程式是
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1) 甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=" —1214" kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=" —566" kJ/mol
则表示甲烷燃烧热的热化学方程式。
(2) 将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是:。
(3)某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是(填序号)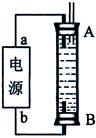
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-= H2↑
(4)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)===CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
| H2O |
CO |
CO2 |
|||
| 1 |
650 |
2 |
4 |
1.6 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
3 |
| 3 |
900 |
1 |
2 |
0.4 |
1 |
①实验1中,以v (H2)表示的平均反应速率为。
②实验3跟实验2相比,改变的条件可能是(答一种情况即可)。
完成下列反应的离子方程式
①磁性氧化铁溶于稀硝酸:
②Ca(HCO3)2溶液中加入少量NaOH溶液:
③明矾溶液中加入Ba(OH)2溶液至生成的沉淀物质的量最多:
④向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:
⑤氢氧化铁溶于氢碘酸中:
(14分) (1) 2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如下图所示。
①请写出从C口通入O2发生的电极反应式___________________。
②以石墨电极电解饱和食盐水,电解开始后在______________的周围(填“阴极”或“阳极”)先出现红色。假设电池的理论效率为80%(电池的理论效率是指电池产生的最大电能与电池反应所释放的全部能量之比),若消耗6.4g甲醇气体,外电路通过的电子个数为__________________(保留两位有效数字)。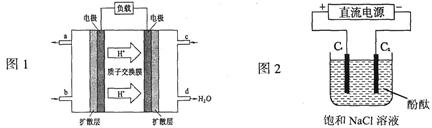
(2)工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18mol2•L-2,Ksp(CuS)=1.3×10-36mol2•L-2。
请用离子方程式说明上述除杂的原理___________________________________________。
(3)工业上为了处理含有Cr2O72-的酸性工业废水,用绿矾(FeSO4·7H2O)把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。
①氧化还原过程的离子方程式为______________________________________________。
②常温下,Cr(OH)3的溶度积Ksp =1×10—32 mol4•L-4,溶液的pH至少为____,才能使Cr3+沉淀完全。
③现用上述方法处理100m3含铬(+6价)78mg•L—1的废水,需用绿矾的质量为kg。(保留主要计算过程)
(13分)Ⅰ.(1)反应I2+2S2O32—=2I—+S4O62—常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择______(填序号)。
①1mL 0.01 mol•L—1的碘水②1mL 0.001 mol•L—1的碘水
③4mL 0.01 mol•L—1的Na2S2O3溶液④4mL 0.001 mol•L—1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算v(S2O32—)=_______________。
Ⅱ.合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g) 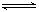 CO2(g)+H2(g) ΔH <0,200℃时,该反应的平衡常数为1/2.25,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol•L—1)变化如下:
CO2(g)+H2(g) ΔH <0,200℃时,该反应的平衡常数为1/2.25,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol•L—1)变化如下:
| 0min |
5min |
10min |
|
| CO |
0.01 |
0.0056 |
|
| H2O |
0.01 |
0.0156 |
|
| CO2 |
0 |
0.0044 |
|
| H2 |
0 |
0.0044 |
(1)请分别计算CO、H2O、CO2、H2的平衡浓度__________,_________,________,_______。
(2)CO的平衡转化率为____________,欲提高CO的转化率,下列措施中可行的是_____(填序号)。
a.增加压强 b.降低温度
c.体积不变,再充入CO d.更换催化剂
e.体积不变,再充入0.1molH2O
(3) 若5min~10min只改变了某一条件,该条件是__________,如何改变的___________。