一定温度下,在一个10 L密闭容器中发生某可逆反应,其平衡常数表达式为K= 。请回答下列问题。
。请回答下列问题。
(1)该反应的化学方程式为__________________________________________;
若温度升高,K增大,则该反应是________反应(填“吸热”或“放热”)。
(2)能判断该反应一定达到平衡状态的是________(填字母序号)。
| A.v正(H2O)=v逆(H2) |
| B.容器中气体的平均相对分子质量不随时间改变 |
| C.消耗n mol H2的同时消耗n mol CO |
| D.容器中物质的总物质的量不随时间改变 |
(3)该反应的v正随时间变化的关系如图,在t2时改变了某种条件,改变的条件可能是________、________。
(4)实验测得t2时刻容器内有1 mol H2O(g),5 min后H2O(g)的物质的量是0.8 mol,这5 min内H2O(g)的平均反应速率为________。
漂白粉是日常生活中的一种常用消毒剂、杀菌剂和漂白剂。请根据要求回答问题:
(1)漂白粉的有效成分是次氯酸钙[Ca(ClO)2],将氯气通入熟石灰(含水的质量分数略小于1%)即可制取,该反应的化学方程式为 ______________________________。
(2)漂白粉具有漂白作用是因为Ca(ClO)2水解生成了次氯酸(HClO),写出该水解反应的离子方程式_______________________________。
(3)Ca(ClO)2溶液中各离子浓度由大到小的顺序是____________________________。
(4)空气中的二氧化碳可以可增强漂白粉的漂白效果,用化学方程式表示其原理__________________________________________。
(5)漂白粉与洁厕剂等强酸性物质混合使用可生成一种有毒气体,写出该反应的离子方程式________________________________________。
(每空1分,共6分)科学家们在探索生命奥秘的过程中,认识到生命细胞的组成和元素周期律有着密切的联系,约占人体总质量99.97%的11种大量元素全部是元素周期表前20号元素,其余0.03%是由10多种人体不可缺少的微量元素组成。现有a~h 8种短周期元素,是除氧、钾、钙外的其他大量元素,它们在元素周期表中的位置如下,请据此回答下列问题:
(1)下列中的元素的原子间反应最容易形成离子键的是。
A.c和f B.b和g C.d和g D.b和e
(2)下列由a~g形成的各分子中所有原子都满足最外层为8电子结构的有。
A.ea3 B.ag C.fg3 D.dg4
(3)由a、e组成的一种化合物化学式为ea5,其各原子均达到同周期稀有气体原子的稳定结构,试写出该化合物的电子式,该物质属于(填“离子”或“共价”)化合物。
(4)均由a、b、h和氧四种元素形成的两种离子化合物,相互反应可生成有刺激性气味的气体。这两种化合物中有一种相对分子质量为120,该化合物熔化时破坏的是(填化学键类型,下同),溶于水时破坏的是。
(每空2分,共8分)请按下列要求作答:
(1)写出将少量二氧化硫气体通入氢氧化钠溶液的化学反应方程式:;
(2)写出将二氧化氮气体通入水中的化学反应方程式:;
(3)写出铜与稀硝酸反应的离子方程式:;
(4)写出氢氧化钡与稀硫酸反应的离子方程式:。
(每空1分,共8分)低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
850 |
| 平衡常数 |
9.94 |
9 |
1 |
请回答下列问题:
(1)上述正反应方向是反应(填“放热”或“吸热”)。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如下图,则0~4 min的平均反应速率v(CO)=mol·L-1·min-1。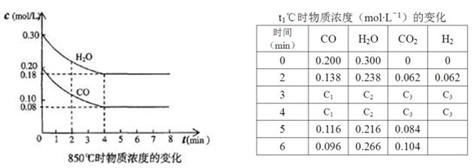
(3)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3 min~4 min之间反应处于状态;C1数值0.08 mol·L-1(填大于、小于或等于)。
②反应在4 min~5 min,平衡向逆方向移动,可能的原因是(单选),表中5 min~6 min之间数值发生变化,可能的原因是(单选)。
A.增加水蒸气 B.降低温度
C.使用催化剂 D.增加氢气浓度
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020 mol·L-1,在该条件下,CO的最大转化率为:。
(5)若在850℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为X;平衡时CO转化率为Y,试推导Y随X变化的函数关系式为。
(每空2分,共8分)熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:
2C4H10+26CO32--52e-=34CO2+10H2O
试回答下列问题:
(1)该燃料电池的化学反应方程式为;
(2)正极电极反应式为。
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是,它来自。