25 ℃时,在体积为2 L的密闭容器中,气态A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A的转化率将增大。
| t2~t3 |
t4~t5 |
t5~t6 |
t7~t8 |
| K1 |
K2 |
K3 |
K4 |
(1)根据图1数据,写出该反应的化学方程式:__________________。此反应的平衡常数表达式K=________,从反应开始到第一次平衡时的平均速率v(A)为________。
(2)在5~7 min内,若K值不变,则此处曲线变化的原因是________________。
(3)如图2表示此反应的反应速率v和时间t的关系图,各阶段的平衡常数如表所示。K1、K2、K3、K4之间的关系为________(用“>”、“<”或“=”连接)。A的转化率最大的一段时间是________。
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。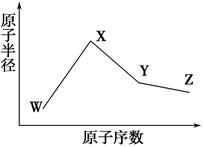
(1)X位于元素周期表中第________周期第________族;W的基态原子核外有________个未成对电子。
(2)Z的气态氢化物和溴化氢相比,较稳定的是________________(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是____________________________________________________。
按照下列元素基态原子的电子排布特征判断元素,并回答问题:A原子中只有一个电子层且只含有一个电子;B原子的3p轨道上得到一个电子后不能再容纳外来电子;C原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;D原子的第三电子层上有8个电子,第四层上只有1个电子;E原子的价电子排布式为3s23p6。
(1)A~E分别是哪种元素(用元素符号填空):
A:__________;B:________;C:__________;D:________;E:________。
(2)E的原子结构示意图________________。
(3)C的轨道表示式____________________。
(4)B原子的核外电子排布式________________。
I.已知几种元素原子的价电子构型为3s2,4s2,4s24p1,3d54s2,3s23p3,它们分别属于第几周期?第几族?最高化合价是多少?各元素符号分别是什么?
Ⅱ.第四周期的A、B、C、D四种元素,其价电子数依次为1、2、2、7,其原子序数依次增大。已知A与B 的次外层电子数均为8,而C与D的次外层电子数均为18。根据原子结构,判断:
(1)A、B、C、D的元素符号分别是________、________、________、________。
(2)写出D与A的简单离子的电子排布式________,________。
(3)哪一种元素的氢氧化物碱性最强?__________________________________________。
(4)B与D两原子间能形成何种化合物?________________。写出化学式及电子式________________,________________。
Ⅰ.某元素有6个电子处于第三电子层d轨道上,推测该元素的原子序数是________,并根据洪特规则推测在第三电子层d轨道上未成对电子的个数是________个。
Ⅱ.核电荷数小于18的两种元素,A原子最外层电子数为a个,次外层电子数为b个;B原子M层电子数为(a-b)个,L层为(a+b)个,则:
(1)写出元素的名称和符号:A.____________________,B.____________________。
(2)写出各原子的核外电子排布的轨道表示式。
已知86Rn(氡)基态原子的电子排布式为1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p6,88Ra基态原子的电子排布式可简化为[Rn]7s2。114号元素是化学家和物理学家很感兴趣的尚未发现的元素。
(1)用简化的形式写出114号元素基态原子的电子排布式: ______________
________________________________________________________________。
(2)根据原子核外电子排布的特征,判断114号元素在周期表中的第________周期________族。
(3)根据114号元素在周期表中的位置判断,它最不应具有的性质是________。
第一电离能大于88Ra
②鲍林电负性大于3.0
③最高化合价为+4价,也可有+2价
④最高价氧化物的对应水化物显碱性