将KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法正确的是 ( )。
| A.整个过程中两电极反应2Cl--2e-=Cl2↑、2H++2e-=H2↑不可能同时发生 |
| B.电解至c点时,往电解液中加入适量CuCl2固体,即可使电解液恢复至原来的浓度 |
| C.ab段表示电解过程中H+被还原,pH上升 |
| D.原混合溶液中KCl和CuSO4的浓度之比恰好为2∶1 |
①14Cu2++5FeS2+12H2O =7Cu2S + 5Fe2+ + 24H++3SO42-
②Mn2+ + S2O82- + H2O—MnO4- + SO42-+ H+
对上述两个反应判断正确的是:
| A.①②反应中SO42—都是氧化产物 | B.两个反应中电子转移数目都是10mol |
| C.①反应中的硫元素既被氧化又被还原 | D.氧化性:MnO4—> S2O82— |
香柠檬酚具有抗氧化功能,它的结构如图,下列说法正确的是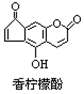
| A.它的分子式为C13H9O4 |
| B.它与H2发生加成反应,1mol最多可消耗7mol H2 |
| C.它与溴水发生反应,1mol最多消耗3mol Br2 |
| D.它与NaOH溶液反应,1mol最多消耗2molNaOH |
下列叙述中,正确的是
| A.1 mol 过氧化钠中阴离子个数为2×6.02×1023 |
| B.14 g乙烯和丙烯的混合物中含有的碳原子的数目为6.02×1023 |
| C.28 g C16O与28 g C18O中含有的质子数均为14×6.02×1023 |
| D.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×1023 |
下列说法正确的是
| A.乙烯和聚乙烯都可与溴水发生加成反应 |
| B.酸性高锰酸钾溶液能鉴别苯、甲苯和四氯化碳 |
| C.(NH4)2SO4、CuSO4、C2H5OH都能使蛋白质变性 |
| D.葡萄糖、麦芽糖、蔗糖均能发生银镜反应 |
下列说法正确的是
| A.Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱 |
| B.Na和Cs属于第IA族元素,Cs失电子能力比Na强 |
| C.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
| D.镁条在空气中燃烧生成的氧化物是MgO,钠在空气中燃烧生成的氧化物是Na2O |