①14Cu2++5FeS2+12H2O =7Cu2S + 5Fe2+ + 24H++3SO42-
②Mn2+ + S2O82- + H2O—MnO4- + SO42-+ H+
对上述两个反应判断正确的是:
| A.①②反应中SO42—都是氧化产物 | B.两个反应中电子转移数目都是10mol |
| C.①反应中的硫元素既被氧化又被还原 | D.氧化性:MnO4—> S2O82— |
X、Y是周期表前二十号元素 ,已知X、Y之间原子序数相差3 ,X、Y能形成化合物M ,下列说法正确的是 ( )
| A.若X、Y处于同一周期,则化合物M不可能是正四面体型分子晶体 |
| B.若X的单质常温下是气体,则Y的单质常温下也是气体 |
| C.若X、Y两元素周期数差1,则属于离子化合物的M只有四种 |
| D.若M属于离子化合物,则其中可能含有非极性键 |
短周期主族元素A、B、C的原子序数依次递增,它们的族序数之和为11,A、C同主族,B原子最外层电子数比A原子次外层电子数多l。下列叙述不正确的是()
A.原子半径:B>C>A
B.A、C两元素的最高价氧化物对应水化物的酸性A强于C
C.C的最高价氧化物只能与碱反应,不能与任何酸反应
D.B的最高价氧化物的熔点比A的最高价氧化物的熔点低
下列化学用语的理解正确的是()
A.某离子结构示意图为: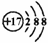 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- |
B.电子式为: 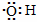 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 |
C.比例模型为: 可以表示甲烷分子,也可以表示四氯化碳分子 可以表示甲烷分子,也可以表示四氯化碳分子 |
| D.铬元素的价电子排布式为3d44s2 |
下列叙述中,正确的是()
| A.两种元素构成的共价化合物分子中的化学键都是极性键 |
| B.含有非极性键的化合物分子一定不是极性分子 |
| C.白磷晶体中,微粒之间通过共价键结合,键角为60° |
| D.金属晶体在熔化时,金属键被破坏,而原子晶体熔化时,共价键不被破坏 |
X、Y、Z均为第三周期元素,X的第一电离能在同周期中最小,Y的电负性在同周期中最大,Z的离子半径在同周期中最小,下列关于X、Y、Z叙述中不正确的是 ()
| A.原子序数和原子半径大小顺序均为:X<Y<Z |
| B.元素X与元素Y能形成离子化合物 |
| C.元素Z最高价氧化物对应水化物具有两性 |
| D.元素Y形成的气态氢化物水溶液呈强酸性 |