锌(Zinc)是第四“常见”的金属,仅次于铁、铝及铜,在现代工业中对于电池制造有不可磨灭的贡献。
Ⅰ.湿法炼锌
某种冶炼过程可用下图简略表示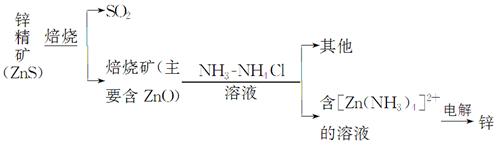
(1)ZnS焙烧反应的化学方程式为_____________________________________。
(2)电解过程中析锌一极的电极反应式为_______________________________。
(3)氧化锌像氧化铝一样,属于两性氧化物,则氧化锌与氢氧化钠反应的离子方程式为_________________________________________________________。
(已知:“锌酸”的化学式可写成H2[Zn(OH)4])
Ⅱ.锌电池
用锌作负极的电池生活中随处可见,如锌锰干电池、锌锰碱性电池、锌空电池等。
(4)锌锰碱性电池,以二氧化锰为正极,锌粒为负极,氢氧化钾溶液为电解液。其具有容量大、放电电流大的特点,因而得到广泛应用。电池总反应式为Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2。
碱性电池中,负极锌由片状改变成粒状的优点是_______________________;正极反应式为________________________________________________________________________。
(5)新型锌空电池(如图)与锂电池相比,锌空气充电电池的储存电量是它的三倍,成本是锂电池的一半,并且完全没有过热爆炸的安全隐患。该电池的总反应为2Zn+O2=2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为__________________________。若以该电池为电源,用惰性电极电解硝酸银溶液,为保证阴极有10.8 g银析出,至少需要________L空气(折算成标准状况)进入该电池。
用“>”、“<”或“=”填空:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),光照和点燃条件的ΔH(化学计量数相同)分别为ΔH1、ΔH2,ΔH1______ΔH2;
(2)相同条件下,2mol氢原子所具有的能量1mol氢分子所具有的能量;
(3)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1_____ΔH2。
①4P(白磷,s) +5O2(g)=2P2O5(s) ΔH1,②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;
(4)已知:101 kPa时,2C(s) +O2(g)=2CO(g) ΔH=-221kJ·mol-1,则碳的燃烧热数值110.5 kJ·mol-1;
(5)已知:稀溶液中,H+(aq)+OH- (aq)=H2O(l) ΔH=-57.3kJ/mol,则浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量57.3 kJ;
(6)可逆反应:aA(气)+bB(气) cC(气)+dD(气);ΔH=Q,根据图回答:
cC(气)+dD(气);ΔH=Q,根据图回答:
P1 ______ P2;②(a+b)______(c+d);③t1℃______ t2℃。
如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题: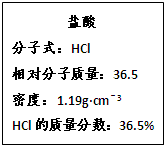
(1)该浓盐酸中HCl的物质的量浓度为___________。若用KMnO4。氧化上述HCl。其反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)1molKMnO4完全反应,反应后溶液的体积为2L,则所得产物中Cl-的物质的量浓度为____________。
(3)8molHCI完全反应,产生的Cl2在标准状况下的体积为_____________。
已知实验室制氯气的化学方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,其中
MnCl2+Cl2↑+2H2O,其中
(1) MnO2中Mn元素被_____________。(填“氧化”或“还原”)
(2) HCI中氯原子___________(填“得到”或“失去”)电子。
(3)反应中还原剂与氧化剂的物质的量之比为______________。
(4)标出此反应中电子转移情况:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
现有失去标签的CaCl2.、AgNO3、HCl和Na2CO3四瓶溶液。为了确定这四种溶液成分,将他们编号为A、B、C、D后进行化学实验。实验记录如下:
| 实验顺序 |
实验内容 |
实验现象 |
| ① |
A+B |
无现象 |
| ② |
B+D |
有气体放出 |
| ③ |
C+B |
有沉淀生成 |
| ④ |
A+D |
有沉淀生成 |
根据上述实验填空:
(1)A、B、C三瓶溶液分别是(用化学式表示):__________、____________、_____________。
(2)写出B和D反应的离子方程式:___________________________________________。
(3)说明A和B不发生反应的理由:___________________________________________。
鉴别下列各组物质,按要求回答问题。
(1)稀硫酸、稀盐酸
①可选作鉴别的试剂有(填编号,可多选)_________。
A.BaCl2溶液 B.Mg(NO3)2溶液 C.Na2CO3溶液
②鉴别反应的离子方程式:_________________________。
(2)饱和碳酸钠溶液、澄清石灰水
①可选用鉴别的试剂有(填编号,可多选)____。
a.盐酸 b.NaCI c.硝酸 d.BaCl2溶液
②依次写出鉴别中有明显现象的反应的离子方程式:________________________________。