研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N元素的电负性由大到小的顺序是___________________________,
C60和金刚石都是碳的同素异形体,二者相比,熔点高的是________,原因是____________________________。
(2)A、B均为短周期金属元素,依据表中数据,写出B的基态原子的电子排布式:________________。
| 电离能/(kJ·mol-1) |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1 821 |
15 390 |
21 771 |
| B |
738 |
1 451 |
7 733 |
10 540 |
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,d0或d10排布无颜色,d1~d9排布有颜色。如[Co(H2O)6]2+显粉红色。据此判断:[Mn(H2O)6]2+________(填“无”或“有”)颜色。
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为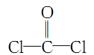 ,每个COCl2分子内含有________个σ键,________个π键,其中心原子采取________杂化轨道方式。
,每个COCl2分子内含有________个σ键,________个π键,其中心原子采取________杂化轨道方式。
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)。反应过程中,断裂的化学键只有配位键,则形成的化学键类型是________。
(9分)有机物A是烃,有机物B易溶于水,且1 mol B能跟足量的钠反应生成标准状况下的H2 11.2 L,但不能与NaHCO3溶液反应,已知A通过如下转化关系可制得化学式为C4H8O2的酯E,且当D→E时,式量增加28。
请回答下列问题:
(1)A在标准状况下的密度为________,反应①的原子利用率为________。
(2)B的密度比水________, B中含氧官能团的名称为________。
(3)反应②的化学方程式为______________。
(4)反应③的反应类型为。
(5)4.4 g C物质完全燃烧消耗mol氧气。
(6)若D→E时,式量增加m,则B的式量为。(用含m的代数式表示)
(9分)如图甲、乙是电化学实验装置。
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为;
②乙中总反应的离子方程式为;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为:
。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为。
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25 ℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入(填写物质的化学式)g。
(8分)在一定体积的密闭容器中,进行如下化学反应:A(g)+B(g)  C(g)+D(g),其化学平衡常数K和温度t的关系如下表:回答下列问题:
C(g)+D(g),其化学平衡常数K和温度t的关系如下表:回答下列问题:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是(多选扣分)。
a. 容器中压强不变; b. 混合气体中c(A)不变; c. v正(B)=v逆(D); d. c(A)=c(C)
(4)某温度下平衡浓度符合下式:c(A)·c(B)=c(C)·c(D),试判断此时的温度为℃。
按要求写出下列反应的化学方程式:
⑴.实验室制备乙烯气体:
⑵.乙醛与新制的银氨溶液加热反应
⑶.乙酸与乙醇反应制备乙酸乙酯
( 4 分)据都市晨报报道,2009年1月13日一天徐州市就发生火灾19起。干粉灭火器是常用的灭火器之一,它利用压缩的二氧化碳吹出白色干粉来灭火。这种灭火器可用来扑灭油、气等燃烧引起的火灾,其中干粉的主要成分是碳酸氢钠(NaHCO3),它受热后生成纯碱、水和二氧化碳。请回答下列问题:[来(1)请写出一条碳酸氢钠的化学性质。
(2)灭火时碳酸氢钠发生反应的化学方程式。
(3)点燃的镁条能在二氧化碳中继续燃烧,生成一种金属氧化物和一种非金属单质,因此金属镁着火时不能干粉灭火剂灭火,请写出镁在二氧化碳中燃烧的化学方程式,属于反应类型。(选填“分解反应”、“化合反应”、“置换反应”、“复分解反应”中的一项)