肼(N2H4)—空气燃料电池是一种环保型碱性燃料电池,电解质为20%~30%的KOH溶液,电池总反应为N2H4+O2=N2+2H2O。下列关于该电池工作时说法中正确的是( )
| A.正极的电极反应式:O2+4H++4e-=2H2O |
| B.溶液中的阴离子向正极移动 |
| C.负极的电极反应式:N2H4+4OH--4e-=4H2O+N2 |
| D.溶液的pH保持不变 |
下列关于叙述正确的是
| A.室温下,浓度均为0.05mol/L的NaOH溶液和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12 |
| B.室温下,将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,2c(SO42-)>c(NH4+) |
| C.室温下,0.1mol/L的盐酸和0.1mol/L的氢氧化钡等体积混合,混合后溶液pH=7 |
| D.室温下,pH=4的醋酸溶液和pH=10的氢氧化钠溶液等体积混合后的溶液pH>7 |
已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O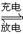 Cd(OH)2+ 2Ni(OH)2有关其说法正确的是
Cd(OH)2+ 2Ni(OH)2有关其说法正确的是
| A.充电过程是化学能转化为电能的过程 |
| B.放电时负极附近溶液的碱性不变 |
| C.放电时电解质溶液中的OH—向正极移动 |
| D.充电时阳极反应:Ni(OH)2-e-+ OH-= NiOOH+H2O |
根据热化学方程式:S(s)+O2(g)=SO2(g)ΔH=akJ·mol—1,分析下列说法中错误的是
| A.S(s)在O2(g)中燃烧是放热反应 |
| B.S(g)+O2(g)=SO2(g)ΔH=bkJ·mol—1,则a<b |
| C.1mol SO2(g)所具有的能量低于1molS(s)与1molO2(g)所具有的能量和 |
| D.16g固体硫在空气中充分燃烧,可放出a/2kJ的热量 |
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是
| A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25℃时,向Mg(OH)2的澄清饱和溶液中加入少量的NH4Cl固体,c(Mg2+)升高 |
| C.25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的溶解度小于在20 mL 0.01mol/LNH4Cl溶液中的溶解度 |
| D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
在25℃时,用蒸馏水稀释1 mol/L的醋酸溶液至0.01 mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是
A. |
B. 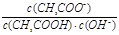 |
C.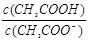 |
D.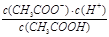 |